有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式(要有计算过程)。若该烃的一氯代物只有一种,试写出该烃的结构简式。
CO,CH4均为常见的可燃气体。
(1)等体积的CO,CH4在相同的条件下分别完全燃烧,转移的电子数之比为 。
(2)120℃,101kPa下,a mL由CO,CH4组成的混合气体在b mL氧气中完全燃烧后,恢复至原来的温度与压强。
①若混合气体与氧气恰好完全反应,产生b mLCO2,则混合气体中CH4的体积分数为多少?
②若燃烧后气体体积缩小了a/4 mL,求a与b关系的数学表达式。
某有机物1.5g在氧气中完全燃烧,生成0.1mol水和1.68L(标准状况)二氧化碳。该有机物的蒸气对空气的相对密度是2.07,求其分子式。
某烃在标准状况下的密度为3.215 g /L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃的相对分子质量;
(2)确定该烃的分子式;
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式________________________。
(8分)将0.2mol某饱和一元醇完全燃烧后,生成的气体缓慢通过盛有0.5L 2mol/L的氢氧化钠溶液中,生成两种钠盐Na2CO3 与 NaHCO3的物质的量之比为1:3。
(1)求该一元醇的分子式。 (2)该醇有几种结构中含羟基的同分异构体。
(3)写出(2)中能被氧化为醛的结构简式。
标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中的水的质量.
(2)若原气体是单一气体,通过计算推断它的分子式.
某有机物A含C:54.8%,H:5.58%,N:7.11%,其余含O,A的相对分子质量不超过300。A是α—氨基酸,分子中不存在甲基(-CH3),能与FeCl3溶液发生显色反应,1molA最多能与3molNaOH完全反应。请回答:
(1)则该物质的分子式是什么?(注:要有计算过程)
(2)写出其物质的任一种符合要求的结构简式。
⑴生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷: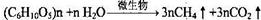
若某植物纤维素的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为 m3。
⑵合成二甲醚主要步骤为造气和合成。过程如下:
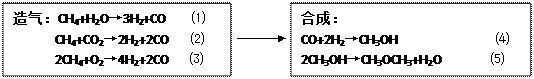 |
若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其他杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2,且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]= m3;V[空气]= m3。
⑶为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O → CO+3H2 ②2CH4+O2 → 2CO+4H2
合成塔Ⅰ:CO+2H2 → CH3OH ; 2CH3OH → CH3OCH3+H2O
合成塔Ⅱ:N2+3H2==2NH3
假设天然气中只含CH4,反应②中通入适量空气,调节①和②投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰好为3:1,以便合成氨。该企业每生产34t NH3理论上同时可以得到二甲醚多少吨?(设工业多次转化,总转化率假定为100%设合成塔Ⅰ中水与CO不反应)?
已知1mol烯烃A完全燃烧需要3mol氧气。某烃B是A的同系物,在常温常压下,10mL气态烃B跟50mL足量氧气混合并点燃,完全反应后恢复到原来状态,测得剩余气体体积为30mL。求:
(1)烃A的化学式为 (不写计算过程);
(2)通过计算确定烃B的化学式和它所有可能的结构简式。(写计算过程)
将含有C、H、O的有机物4.88 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了12.32g。已知该有机物的相对分子质量为122。
(1)通过计算确定该有机物的分子式。
(2)如果该有机物1个分子中存在1个苯环和1个侧链,试写出它的所有同分异构体的结构简式。
某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68 g/L(折算成标准状况),该有机物能与金属钠反应。
(1)通过计算求出该有机物的分子式。(2)写出该有机物可能的结构简式。
取8 g某有机物A(相对分子质量为32)在氧气中完全燃烧,生成物中只有11 g CO2和9 g H2O。通过计算推断:
(1)该有机物A中含有的元素。
(2)该有机物的分子式及可能的结构简式。
由H2、C2H4、C2H2组成的1L混合气体,在一定条件下发生加成反应后,气体总体积变成了XL。请回答(气体体积均在标准状况下测定)
⑴当反应后三种气体均无剩余时,X的取值范围是 ;
⑵若反应后三种气体均无剩余,X=0.4时,原混合气体H2、C2H4、C2H2的体积比为 ;
⑶若X=0.6时,且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H4、C2H2的体积之比为 。
有机化合物A含有C、H、O三种元素,取该有机物0.2 mol 和0.9 mol O2在密闭容器中燃烧,产物为CO、CO2和H2O(g),把产物依次通过浓硫酸、灼热的氧化铜和碱石灰。结果,浓H2S O4的质量重了18g ,CuO的质量轻了9.6g ,碱石灰的
O4的质量重了18g ,CuO的质量轻了9.6g ,碱石灰的 质量增重了35.2g。
质量增重了35.2g。
 (1)通过计算确定有机物A的分子式;
(1)通过计算确定有机物A的分子式; (2)若A可与金属钠反应生成氢气,且A分子中含有手性碳原
(2)若A可与金属钠反应生成氢气,且A分子中含有手性碳原 子,请写出A的结构简式。
子,请写出A的结构简式。