某校化学兴趣小组通过以下路线合成某镇静药物F:
已知:
①A属于苯的同系物,1molA完全燃烧需要9mol氧气;
②B核磁共振氢谱表明分子中有4种化学环境的氢,峰面积之比为2:2:2:1;
③ 。
。
(1)A中碳原子的杂化轨道类型有______;D分子中的官能团名称为_______,检验该官能团的化学试剂是_________________;(填名称)
(2)B转化为C的化学方程式为_________________________;
(3)E与C反应生成F的化学方程式为_______________,反应类型为_____________。
(4)2分子E反应生成一种含有3个6元环的有机物,该有机物的结构简式为_________。
(5)E有多种同分异构体,其中符合下列条件的同分异构体有几种___________。
①其水溶液遇FeCl3溶液呈紫色;
②苯环上有2个取代基;
③能发生银镜反应
现有A、B、C、D、E五种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
该元素的最外层电子数是次外层电子数的2倍 |
| B |
该元素形成的最简单氢化物常用作制冷剂 |
| C |
该元素是电负性最大的元素 |
| D |
该元素的一种氧化物具有磁性 |
| E |
E+原子核外有3层电子且各层均处于全满状态 |
根据以上信息,回答下列问题:
(1)A、B、C三种元素的第一电离能由大到小的顺序是 (用元素符号表示);E基态原子价电子电子排布式是__________。
(2)BC3分子的空间构型为 ,B和C两元素的氢化物的沸点相比较,较高的是 (写分子式)
(3)一定条件下,A元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有______个A原子。

(4)图2为D元素的单质形成的某种晶体的晶胞结构,已知该晶体的密度为a g/cm3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
(5)向E的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
一定条件下存在反应:2E(g)+F(g) 2G(g) △H>0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2G(g) △H>0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中反应达到平衡的时间:II<III |
| C.容器Ⅱ、Ⅲ中的反应达平衡时,G的体积分数:II>III |
| D.容器Ⅰ中E的转化率与容器Ⅱ中G的转化率之和大于1 |
下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/L的KHA溶液,其pH=10:c(K+)>c(A2-)>c(HA-)>c(OH-) |
| B.常温下pH=12氨水与pH=2盐酸等体积混合,则溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+) |
| D.将0.2mol·L-1CH3COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:c(CH3COO一)+c(CH3COOH)=2c(Na+) |
能正确表示下列反应的离子方程式是
| A.Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-=Fe4[Fe(CN)6]2↓ |
下列溶液中,离子浓度的关系一定正确的是
| A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) |
| B.在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1 |
| C.1L0.1mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH—)+c (SO42—) |
| D.pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3) |
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
下列说法正确的是
| A.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| B.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| C.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |
【实验化学】制备水杨酸对正辛基苯基酯( )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。

该反应为:
 (水杨酸)+SOCl2—→
(水杨酸)+SOCl2—→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[ ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
(15分)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| |
Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
①试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③灼烧完全的标志是 。
④若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
碱式碳酸镁[Mgx(CO3)y(OH)z•nH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: 。
②氢氧化镁浆液与CO2反应的化学方程式为: 。
③碱式碳酸镁用乙醇洗涤的目的是: 。
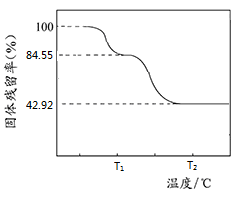
(2)某同学将4.66g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重1.76g。样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
电解精炼铜时产生大量阳极泥,实验室用阳极泥(主要含有铜、银、金、铂、镍等)制备高纯硝酸银溶液和氧化铜。

(1)酸溶时银发生反应的离子方程式为 ;滤渣Ⅰ主要成分为 。
向溶液中通入氧气可以有效降低反应产的污染气体,其原因是 。
(2)热处理时产生棕色气体转移到酸溶池中,硝酸铜分解反应方程式为 ;热处理要保持温度200℃,且要保持一段时间,其目的是 和分离出铜。
(3)加入Al(OH)3调节溶液的pH,使大部分杂质离子生成沉淀除去;操作中控制Al(OH)3稍过量来获得纯净的硝酸银,Al(OH)3稍过量的目的是 。
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.物质的量浓度相等的① (NH4)2SO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③ |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol·L-1 |
| D.物质的量浓度之比为1∶1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-) |
菠菜营养丰富,在营养价值上是一种高效的补铁剂。但因草酸含量高,因而吃起来有涩味。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁;
②菠菜中草酸及草酸盐的含量(以C2O42-计);
通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
Ⅰ.取菠菜样品,按如下步骤进行实验,观察实验现象。

Ⅱ.另取一份菠菜样品研磨成汁后,在少量开水中煮沸2~3 min,冷却后过滤得滤液。向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象。并过滤得CaC2O4固体。
Ⅲ.用稀HCl溶解CaC2O4,并加水配制成100mL溶液.每次准确移取25.00mL该溶液,用0.0100mol•L-1KMnO4标准溶液滴定,平均消耗标准溶液VmL。(不考虑Cl-被KMnO4氧化。)
请回答以下问题:
(1)操作①中使用的仪器除三脚架、泥三角、酒精灯、玻璃棒外,还需要的硅酸盐质仪器 ,操作②的名称是 。
(2)通过资料分析,菠菜中的Fe是+2价还是+3价? 。
步骤I中 (填现象)可以证明该结论?
(3)通过步骤Ⅱ可以确定菠菜中含有草酸类物质。由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰。
则X是 (写化学式),加入试剂X后可观察到沉淀部分溶解。
(4)步骤Ⅲ中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 ,该步骤中滴定操作的终点如何判断________________;所涉及的离子反应方程式 。
(5)若样品的质量为W g,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为___ __。
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:


回答下列问题:
(1)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_______ 。
(2)常温下,用H2O2充分氧化Fe2+后,再调pH=4,目的是____ ___。
此时溶液中c(Fe3+)= ________ 。(已知25℃时,Fe(OH)3的Ksp= 2.64×10—39)。
(3)H2O2也可用NaClO3代替,写出在酸性条件下用氯酸钠氧化Fe2+的离子方程式为: 。
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,
这两步操作的 ______。
(5)操作Ⅰ的步骤是:调pH为2~3,蒸发浓缩,冷却结晶,过滤,用少量乙醇洗涤并晾干。
则“调pH为2~3”的目的是_________ ______。
(6)产品晶体中有时会混有少量的绿矾FeSO4· 7H2O 其原因可能是___ ______。
从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯可以得到二氢荆芥内酯,后者是有效的驱虫剂。下图是二氢荆芥内酯的一种合成路线:

(1)G的分子式是 ;F→G的反应类型是 。
(2)请写出E的结构简式_________________________。
(3)请写出生成B→C的化学方程式_____________________________________________。
(4)下列有关上述化合物的说法正确的是 。
①A的官能团检验顺序为:先加银氨溶液,水浴加热;再加溴水。
②A和B都能用NaHCO3溶液和NaOH溶液区分
③B和F互为同分异构体
④1 mol D最多能消耗2molNaOH
(5)某物质X:①分子组成比A少2个氢原子;②能与FeCl3溶液发生显色反应;③核磁共振氢谱有4组峰。写出符合上述条件的X的结构简式:________________________________(任写一种)。
(6)一定条件下,CH2=CHCHO与CH3OH也可以发生类似A→C的反应,则最终所得有机产物的结构简式为__________________。