NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
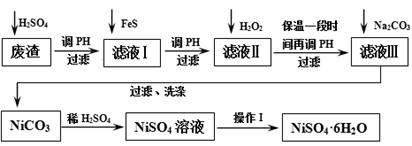
回答下列问题:
(1)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_______ 。
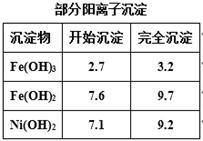
(2)常温下,用H2O2充分氧化Fe2+后,再调pH=4,目的是____ ___。
此时溶液中c(Fe3+)= ________ 。(已知25℃时,Fe(OH)3的Ksp= 2.64×10—39)。
(3)H2O2也可用NaClO3代替,写出在酸性条件下用氯酸钠氧化Fe2+的离子方程式为: 。
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,
这两步操作的 ______。
(5)操作Ⅰ的步骤是:调pH为2~3,蒸发浓缩,冷却结晶,过滤,用少量乙醇洗涤并晾干。
则“调pH为2~3”的目的是_________ ______。
(6)产品晶体中有时会混有少量的绿矾FeSO4· 7H2O 其原因可能是___ ______。
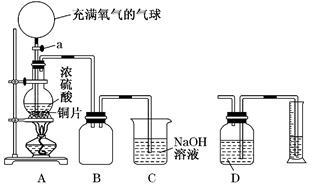

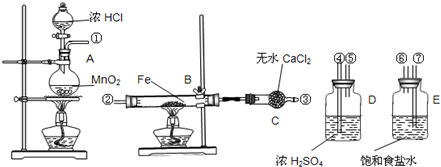
 分别与H2O和浓盐酸反应,有如下现象:
分别与H2O和浓盐酸反应,有如下现象:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号