常温下,pH>7的某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,下列描述正确的是
| A.该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成 |
| B.该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
将0.1摩尔镁、铝混合物粉末溶于200mL0.5mol/L的硫酸中,反应一段时间后,再加入150mL2mol/L的氢氧化钠溶液,待反应完全,此时溶液中大量存在的是
| A.Na+, Mg2+ | B.Na+,AlO2- |
| C.Mg2+,AlO2- | D.Al3+,Mg2+ |
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)
| A.若OA=AB,则溶液X为碳酸钠溶液 |
| B.若OA=0,则形成溶液X所发生反应的离子方程式为OH-+CO2=HCO3- |
| C.若OA>AB,则溶液X中大量存在的阴离子为碳酸根离子和碳酸氢根离子 |
| D.若3OA=AB,则溶液X中c(NaHCO3)=2c(Na2CO3) |
下列离子方程式正确的是
| A.向碘化亚铁溶液中通入足量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| B.碳酸氢钠溶液与过量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
| C.用浓盐酸配制的高锰酸钾溶液与过氧化氢反应:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| D.硫酸氢钠溶液与氢氧化钡溶液以等物质的量混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
下列事实不能用勒夏特列原理解释的是
| A.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 |
| B.增大压强可加快SO2转化为SO3的速率 |
| C.黄绿色的氯水光照后颜色变浅 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 | C.正、逆反应的速率 | D.反应物的转化率 |
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为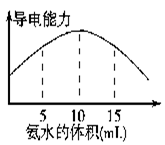
| A.0.5% | B.1.5% | C.0.1% | D.1% |
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)·c(OH-) = 10-22,则该小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
| A.13 | B.12 | C.11 | D.10 |
在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
| A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
在甲酸的下列性质中,可以证明它是弱电解质的是
| A.在相同条件下,甲酸的导电性比强酸溶液的导电性弱 |
| B.甲酸能与水以任意比互溶 |
| C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
下列有关金属腐蚀与防护的说法正确的是( )
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
| A.达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20% |
| B.甲中NH3的体积分数与乙相等 |
| C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol N2(g)+3H2(g);△H=+Q2KJ/mol |
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=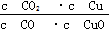 |
B.反应③的平衡常数K=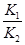 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
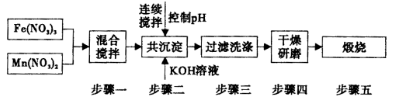
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
下列有关化学用语表示正确的是
A. 为羟基的电子式,也是氢氧根离子的电子式 为羟基的电子式,也是氢氧根离子的电子式 |
B.S2-的结构示意图: |
C.甲烷分子的比例模型是 |
| D.中子数为10的氧原子:18O |