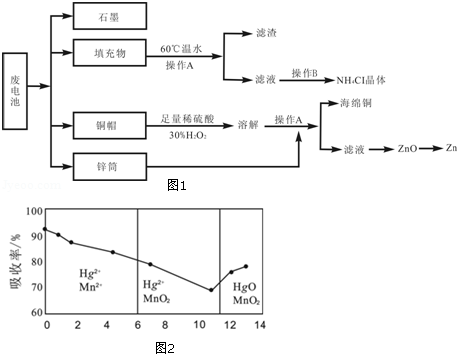
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如图1处理方法回收废电池中的各种资源.
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2.
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
根据图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 .
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)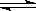 2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
| |
恒容容器甲 |
恒压容器乙 |
| Y的物质的量/mol |
n1 |
n2 |
| Z的体积分数 |
φ1 |
φ2 |
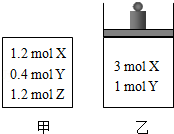
A.平衡时容器乙的容积一定比反应前大
B.平衡时容器甲的压强一定比反应前大
C.n2>n1
D.φ2>φ1
实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )

| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO,实验流程如下:

请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)__________ Ksp(ZnS)(选填“>”“<”或“=”).
(2)甲、乙两同学选用下列仪器,采用不同的方法制取氨气。

①甲同学使用的药品是熟石灰与氯化铵,则应选用装置__________(填写装置代号)
②乙同学选用了装置B,则使用的两种药品的名称为_________。
(3)沉淀过程需降温冷却的原因为 、 。
(4)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式 。
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子: |
B.N2的电子式: |
C.S2-的结构示意图: |
| D.丙醛的结构简式:CH3CH2COH |
下列表示对应化学反应的离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
下列有关物质的性质和该性质的应用均正确的是
| A.炭具有强还原性,高温下能将二氧化硅还原为硅 |
| B.Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg |
| C.光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 |
| D.二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
21世纪化学的最新定义为“化学是一门创造新物质的科学”。下列有关说法不正确的是
| A.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 |
| B.开发利用太阳能、生物质能等清洁能源,有利于节约资源 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.制备物质时探究化学反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
化学与科学、社会、技术和环境密切相关。下列有关说法中错误的是
| A.目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 |
| B.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| C.CO2、CH4、氟氯代烃等都会造成温室效应,因此都属于大气污染物 |
| D.绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
常温常压下二氧化碳和过氧化钠反应后得到碳酸钠和氧气,若反应中固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| A.参与反应的过氧化钠中含阴离子2 mol |
| B.参与反应的二氧化碳的体积为22.4 L |
| C.反应中电子转移的数目为NA个 |
| D.将生成的碳酸钠溶解在1L水中,能得到1mol/L的碳酸钠溶液 |
化学与社会、生产、生活密切相关。下列说法正确的是
| A.苯酚遇石蕊显红色 | B.食用花生油能发生水解反应 |
| C.包装用材料聚氯乙烯属于烃 | D.PX项目中的对二甲苯属于饱和烃 |
物质的量浓度相等的三种溶液:①H2CO3②NaOH③Na2CO3溶液,下列说法不正确的是
| A.水电离出的c(OH):③>①>② |
| B.溶液的pH:②>③>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
下列环保建议中,你认为不能采纳的是
| A.开发、使用新能源 |
| B.废旧电池应集中回收,并填埋处理 |
| C.用天然气代替汽油和柴油作发动机燃料 |
| D.禁止将未经处理的工业废水和生活污水任意排放 |
维拉左酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如如:

已知:①
②
(1)反应类型:反应④ 反应⑤
(2)结构简式:A C
(3)写出反应②的化学方程式: 。
实验中反应②必须在碳酸钾弱碱性条件下进行的原因是 。
(4)合成过程中反应③与反应④不能颠倒的理由为 。
(5)反应⑥中,(Boc)2是有由两分子C5H10O3脱水形成的酸酐,写出分子式为C5H10O3,且分子中只含有2种不同化学环境氢原子,能发生水解反应的结构简式(书写2种): 、 。
(6)实验室还可以用 和
和 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。