一份质量为2g的合金,与足量的盐酸完全反应生成0.1 g H2,则该合金可能是
| A.Fe-Zn合金 | B.Fe-Cu合金 |
| C.Fe-Mg合金 | D.Mg- Al合金 |
下列物理量与所对应的单位不正确的是
| A.n:mol | B.M:g.mol-1 | C.Vm,:L.mol-l | D.NA:个 |
用 NA 表示阿伏伽德罗常数的值,下列叙述正确的是()
| A.22.4LCO2 与足量的 Na2O2 反应时,转移的电子数为 NA 个 |
| B.0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA 个 |
C.对于反应:A(g)+B(g)  C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 |
| D.Zn -H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g |
在 A+2B  3C+4D 反应中,表示该反应速率最快的是 ()
3C+4D 反应中,表示该反应速率最快的是 ()
A.v(A)=0.3 mol/(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·min)
下列因素不会影响化学反应速率的是
| A.温度 | B.压强 | C.时间 | D.浓度 |
国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”。我国政府即将启动“酱油补铁工程”。这里的铁是指
| A.铁元素 | B.铁单质 | C.四氧化三铁 | D.硫酸铁 |
光纤通信是以光作为信息的载体,让光在光导纤维中传播,制造光导纤维的原料是
| A.银 | B.铜 | C.铝 | D.石英砂 |
下列现象与水污染无关的是
| A.赤潮 | B.水华 | C.水俣病 | D.潮汐 |
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: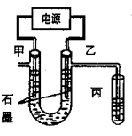
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是
| A.该电池负极的电极反应为:Al﹣3e﹣═Al3+ |
| B.电池工作时,溶液中的铝离子向正极移动 |
| C.该电池可能是一种可充电的二次电池 |
| D.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 |
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )
| A.标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023 mol-1 |
| B.28g乙烯所含共用电子对数目为4×6.02×1023 mol-1 |
| C.1mol 苯中含有碳碳双键的数目为3×6.02×1023 mol-1 |
| D.2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023 mol-1 |
已知维生素A的结构简式如下图,关于它的叙述中不正确的是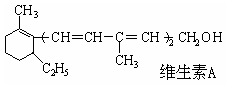
| A.维生素A的一个分子中有五个双键 |
| B.维生素A的一个分子中有30个氢原子 |
| C.维生素A能使溴水褪色,能被酸性KMnO4氧化 |
| D.维生素A是一种烯烃 |