下列有关说法正确的是()
| A. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B. |
|
| C. |
加热0.1
|
| D. |
对于乙酸与乙醇的酯化反应(
|
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为。
②图中四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红()的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应的平衡常数
=0.25。
①t℃时,反应达到平衡时=。
②若在1 密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ |
铁粉/ |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
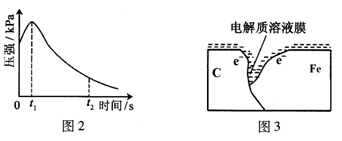
(3)该小组对图2中0~时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
下列说法正确的是
| A.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| B.火电是将燃料中的化学能直接转化为电能的过程 |
| C.将煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D.化学反应的限度不可以通过改变条件而改变 |
下列叙述正确的是
| A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
B.下图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H+ +4e-=2H2O |
| D.电镀时,通常把待镀的金属制品作阳极 |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘低。 
下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是( )

| A.甲区呈现红色 | B.乙区产生Zn2+ |
| C.丙区发生的电极反应式:Cu-2e-= Cu2+ | D.丁区呈现蓝色 |
下列与金属腐蚀有关的说法正确的是( )

| A. |
图
|
| B. |
图
|
| C. |
图
|
| D. |
图
|
下列有关说法不正确的是
| A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l) H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 |
| D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+ |
下列说法不正确的是( )
| A.煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B.侯氏制碱法的工艺过程,应用了物质溶解度的差异 |
| C.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 |
| D.甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽 |
下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 ( )
| A.Y>Z>W>X | B.Z>Y>W>X | C.W>Z>Y>X | D.X>Y>Z>W |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
| A.2H++2e-=H2↑ | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |