铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的 △H= kJ·mol-1。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色(b),如图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
| A.铁棒AB段发生反应为O2 + 4e- + 2H2O = 4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质原因是铁棒所处的化学环境不同 |
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=Fe3+ |
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.②>①>③>④ | C.④>②>③>① | D.③>②>④>① |
高炉炼铁过程中发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.653 |
42.875 |
(1)写出该反应的平衡常数表达式:K=____ _____。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= ;平衡时,c(CO)= 。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的体积
F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是 。
| n(Fe2O3) |
0.350 |
0.027 |
0.080 |
0.080 |
| n(CO) |
0.010 |
0.010 |
0.010 |
0.050 |
| n(Fe) |
0.100 |
0.064 |
0.080 |
0.080 |
| n(CO2) |
0.035 |
0.088 |
0.040 |
0.050 |
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________。
下列叙述不正确的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 |
| D.铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时, d上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>a>c>d |
在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.
(1)分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察图1:____ 号试管中的铁钉最容易生锈.由此可见,铁制品生锈需要的条件是____ _____ .
(2)如图2所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)____.
(3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
①钢铁在发生电化学腐蚀时,负极反应为:________ _ .
②请写出用稀硫酸除去铁锈的化学反应方程式为:____ _____ .
③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_________ 、 _____ .
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 |
下列物质性质与应用及其对应关系均正确的是
| 选项 |
性质 |
应用 |
| A |
碳酸氢钠可与烧碱反应 |
可用碳酸氢钠作糕点膨松剂 |
| B |
AgCl难溶于稀硝酸 |
可用稀硝酸和AgNO3溶液检测Cl- |
| C |
浓硫酸具有强氧化性,而稀硫酸的氧化性较弱 |
可用浓硫酸替代稀硫酸与锌反应快速制氢气 |
| D |
碳单质性质稳定 |
可在纯铁中加入少量炭增强抗腐蚀性 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度延长糕点保质期 |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e— ===H2 ↑ | B.Fe-2e—===Fe2+ |
| C.2H2O+O2+4e— ===4OH— | D.Fe-3e—===Fe3+ |
下列相关化学知识的说法正确的是
| A.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
| B.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
| C.蛋白质和油脂在一定条件下都能水解,水解产物不同,但两者都属于高分子化合物 |
| D.分子数为NA的C2H4气体体积约为 22.4 L,其质量为 28 g(N A-阿伏加德罗常数) |
下列与金属腐蚀有关的说法正确的是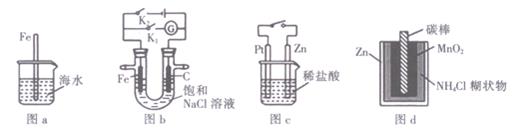
| A.图a中,插人海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 |
| C.图c中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |