常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
| A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱 |
| B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
| C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比 |
| D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 |
沉淀滴定和中和滴定的原理相同,如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO为指示剂,这是因为AgCl的溶解度比Ag2CrO4的溶解度________的缘故(填“大”或“小”),其实难溶性银盐较多,溶度积如下表:
| 银盐 性质 |
AgCl |
AgI |
AgCN |
Ag2CrO4 |
AgSCN |
| 沉淀颜色 |
白 |
黄 |
白 |
砖红 |
白 |
| 溶度积: |
1.8×10-10 |
8.3×10-17 |
1.2×10-10 |
1.2×10-12 |
1.0×10-12 |
若用AgNO3去滴定KSCN溶液,可选用为滴定的合适指示剂有( )
A.NaCl B.KI C.NaCN D.Na2CrO4
刚好达到滴定终点时,发生的离子反应方程式为______________________。
(1)己知Na2SO3溶液中存在水解平衡:SO32﹣+H2O HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有 ;操作和 现象是 。
HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有 ;操作和 现象是 。
(2)已知等物质的量浓度的醋酸和醋酸钠溶液等体积混合呈酸性是因为醋酸的电离常数 醋酸钠的水解常数(选填“大于”、“小于”或“等于”);可知该温度下醋酸钠(或醋酸根)的水解常数______ 1.0×10-7 (选填“大于”、“小于”或“等于”)
已知下表数据:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25 ℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中[SO42-]∶([Cu2+]+[Fe2+]+[Fe3+])>5∶4 。([SO42-]表示SO42-物质的量浓度 )
C.向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液
D.在pH=4的溶液中Fe3+不能大量存在
下列实验“操作和现象”与“结论”对应关系均正确的是( )
| |
操作和现象 |
结论 |
| A |
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 |
Ksp:CaCO3<CaSO4 |
| B |
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 |
该电极为阳极 |
| C |
向FeCl3和CuCl2混合溶液中加入少量铁粉,有红色固体析出 |
氧化性:Cu2+<Fe3+ |
| D |
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有Ag+ |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为____________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为__________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
已知AgCl的溶解度为1.5×10-4g , AgBr的溶解度为8.4×10-6g ,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀多于AgBr沉淀 | D.AgCl沉淀少于AgBr沉淀 |
Na2FeO4是一种高效的水处理剂,下列用于解释事实的方程式中,不正确的是
| A.Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| B.工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为: 2FeCl3+10NaOH+3NaClO ="==" 2 Na2FeO4+9NaCl+5H2O |
| C.Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为: 4FeO42-+10H2O ="==" 4Fe3++20OH-+3O2↑ |
| D.工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为: |
Fe-6e-+8OH-="==" FeO42-+4H2O
溴酸银(AgBrO3)的溶解度随温度变化曲线如右上图所示,下列说法正确的是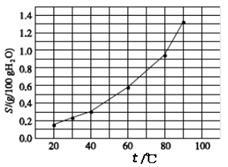
| A.温度升高不利于溴酸银的溶解 |
| B.溴酸银的溶解是放热过程 |
| C.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
| D.60 ℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
25℃,两种酸的电离常数如下表。
| |
Ka1 |
Ka2 |
| H2A |
1.3×10-2 |
6.3×10-6 |
| H2B |
4.2×10-7 |
5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为: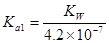
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
| A.25℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25℃时,向含有等物质的量的FeCl2和CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS |
| C.除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 |
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为 |
已知下列物质在20 ℃下的Ksp如下,试回答下列问题
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是__________________;
(2)向浓度均为0.1mol/L的KCl和KBr混合溶液中加入足量AgNO3溶液,当两种沉淀共存时, =________________。
=________________。
(3)向AgBr的饱和溶液中加入Na2S溶液,反应的离子方程式是______________。该反应的平衡常数表达式是:_____________。
(4)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂______________。
| A.KBr | B.KI | C.K2S | D.K2CrO4 |