自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是
| A.原生铜的硫化物具有还原性 |
| B.常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 |
C.铜蓝的形成过程是: ZnS(S) + Cu2+ CuS(S) + Zn2+ CuS(S) + Zn2+ |
| D.硝酸型酸雨不利于铜蓝的形成: CuS + 2H+ = Cu2+ + H2S↑ |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI> AgCl> Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于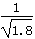 ×10-11mol·L-1 ×10-11mol·L-1 |
在饱和Mg(OH) 2溶液中,c(OH-)=1.0×10-4 mol·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH) 2的溶解度在理论上将( )
| A.变为原来的10-3倍 | B.变为 原来的10-2倍 |
| C.变为原来的103倍 | D.不发生变化 |
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| |
Ka1 |
Ka2 |
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
| 实验编号 |
实验操作 |
实验现象 |
| ① |
滴入KSCN溶液 |
溶液变红色 |
| ② |
滴入AgNO3溶液 |
有黄色沉淀生成 |
| ③ |
滴入K3[Fe(CN)6]溶液 |
有蓝色沉淀生成 |
| ④ |
滴入淀粉溶液 |
溶液变蓝色 |
A.①和② B.②和④ C.③和④ D.①和③
向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
| A.白色沉淀 | B.液体分层 | C.无明显现象 | D.黄绿色气体 |
在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:

(1)图中C点表示当加入 mol NaOH时,Al3+已完全转化为 (填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 。
CaCO3是一种难溶物质,其Ksp=2.8×10-9 , 先将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为多少?(写出计算过程)
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
25℃时,Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,下列说法正确的是( )
| A.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 |
| B.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣) |
C.AgCl和Ag2CrO4共存的悬浊液中,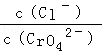 = =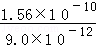 |
| D.向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为( )
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L | C.1.8×10-9mol/L | D.1.8×10-10mol/L |