工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4 ·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表。

| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀的 pH |
3.3 |
1.5 |
6.5 |
5.4 |
4.2 |
| 沉淀完全的 pH |
5.2 |
3.7 |
9.7 |
8.0 |
6.7 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有____________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是______________。为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为__________________。为控制上述pH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于_______________。
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Cu(OH)2](填“>”、“=”或“<”)
用离子方程式解释下列过程:
(1)纯碱溶液显碱性:____________________。
(2)泡沫灭火器的反应原理(硫酸铝溶液与小苏打):_______________________。
(3) AgCl的浊液中加入KI溶液,白色沉淀变为黄色:____________________。
己知Ksp(AgCl) =1.56×10-10,Ksp(AgBr) =7.7×10-13,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.0l0mol/L,向该溶液中逐滴加入0.0l0mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
常温时,M(OH)2的Ksp=4×10-6,将0.32mol/L的MCl2溶液与pH为12的氨水等体积混合,有关叙述不正确的是( )
| A.混合溶液中的Cl-离子浓度为0.32mol/L |
| B.混合后溶液中c (NH4+)/c (NH3·H2O)比值变小 |
| C.混合溶液对于M(OH)2为饱和溶液 |
| D.会有M(OH)2沉淀生成 |
一定温度下,AgCl在相同体积的下列液体中溶解量最大的是( )
| A.纯水 | B.0.1mol/L的HCl | C.0.1mol/L的MgCl2 | D.0.1mol/L的AgNO3 |
已知各物质的溶度积:Ksp (FeS) =6.3×10-18mol2·L-2 , Ksp (CuS) =1.3×10-36mol2·L-2
下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol•L-1,,K[MgF2]=7.43×10-11.下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
下列有关实验的说法正确的是
| A.用干燥的pH试纸测定新制氯水的pH |
| B.中和滴定实验中,洗净后的锥形瓶不需要干燥 |
| C.用Na2S溶液与AlCl3溶液混合制取Al2S3 |
| D.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(Br-)/c(Cl-)的比值约为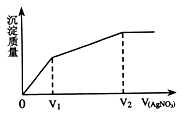
| A.V1/(V2-V1) | B.V1/V2 | C.(V2-V1)/V1 | D.V2/V1 |
化学与生产、生活密切相关,下列叙述错误的是
| A.用热的纯碱溶液清除灶具上的油污 |
| B.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
| C.用硫酸清洗锅炉中的水垢 |
| D.用明矾[KAl(SO4)2·12H2O]作净水剂,除去水中悬浮的杂质 |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp |
1.8×10-10 |
8.51×10-16 |
6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
| A.水的电离程度始终增大 |
| B.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.c(NH4+)/c(NH3•H2O)先增大再减小 |
化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=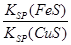
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
| A.②③ | B.①③④ | C.①② | D.②③④ |
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(
提示:离子沉淀(或沉淀溶解)pH见下表
| 离子 |
Mg2+ |
Al 3+ |
物质 |
Al(OH)3 |
| 开始沉淀pH |
8.93 |
3.56 |
开始溶解pH |
8.04 |
| 完全沉淀pH |
10.92 |
4.89 |
完全溶解pH |
12.04 |

部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25 ℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.HCN + HCOONa = NaCN + HCOOH