一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
| A.5∶3 | B.5∶4 |
| C.1∶1 | D.3∶5 |
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O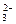 将转化成
将转化成
| A.S2- | B.S |
C.SO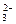 |
D.SO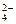 |
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO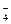 →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO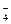 |
| C.Cl2 | D.HNO2 |
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为
| A.1∶1∶1 | B.2∶2∶1 |
| C.2∶3∶1 | D.4∶3∶2 |
已知双氧水仅发生:H2O2 O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为( )
O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为( )
| A.1:2:1:2 | B.1:2:2:2 | C.1:2:2:1 | D.2:1:1:2 |
用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ·mol-1 ②CH4 ( g ) + 4NO ( g ) = 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ·mol一1下列说法不正确的是
| A.由反应①可推知:CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( l) ; △H>一574 kJ·mol-1 |
| B.反应①②转移的电子数相同 |
| C.若用标准状况下 4.48LCH4还原 NO2至 N2,放出的热量为 173.4kJ。 |
| D.若用标准状况下 4.48LCH4还原 NO2至 N2,整个过程中转移的电子总数为1.60 mol |
元素X 的离子和其含氧酸根离子,在 pH=0的溶液中产生X 的单质沉淀,且氧化产物与还原产物质量之比为 2 : 1 . X 可能是
| A.氯 | B.硫 | C.硅 | D.铝 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
| A.该反应既是分解反应,又是氧化还原反应 |
| B.变蓝的淀粉碘化钾试纸褪色可能发生的反应: 5C12+I2+6H2O=12H++10Cl—+2IO3— |
| C.若化学计量数a=8,b=3,则该反应转移电子数为20e— |
| D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的 |
将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
| A.6g | B.8g | C.10g | D.10.2g |
已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
 (1)写出该反应配平的化学方程式:
(1)写出该反应配平的化学方程式:  (2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。 (3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: ;
、
、
、
四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
a Fe+b NO3-+c H+="=d" Fe2++f Fe3++g NO↑+h N2O↑+k H2O(化学计量数均为正整数)
请你用已掌握的知识研究出下列规律。
(1) c、g、h的关系式是____________________。
(2) b、c、d、f的关系式是_________________________。
(3) d、f、g、h的关系式是_________________。
(4)若a =12,铁和硝酸恰好完全反应,则b的取值范围是________________。c的取值范围是______________________。