0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
NO分子曾因污染空气而臭名昭著。Murad等三位教授最早提出NO分子在人体内有独特功能,近来此领域研究有很大进展而荣获了1998年诺贝尔医学及生理学奖。
NO对环境的危害在于(填编号,有一个或多个答案) 。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 |
| C.造成酸雨 | D.与人体内的血红蛋白结合 |
在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式 。
常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50度,发现气体的压强迅速下降,降至略小于原压强的2/3就不在改变,已知产物之一为N2O,写出上述变化的化学方程式 。
解释变化(3)中为什么最后的气体总压力略小于原压力的2/3?(用化学方程式表示) 。
浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气。
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C……)____ ____。
(2)E中发生反应的化学方程式是____ ____。
(3)装置④中应当选用的干燥剂是(写名称)____ _______。
(4)装置①中发生氧化还原反应的化学方程式是___ ________。其中氧化剂是____ __,氧化产物是______ __(写化学式)。
(5)装置②中浓硫酸的作用是_____ ____。
下列有关、
、
等非金属元素化合物的说法正确的是( )
| A. | 漂白粉的成分为次氯酸钙 |
| B. | 实验室可用浓硫酸干燥氨气 |
| C. |
实验室可用
|
| D. |
|
(A)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1中,沉淀最终变为色,写出沉淀变色的化学方程式。
(2)实验2甲针筒内的现象是:有生成,活塞移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入溶液中。
(3)实验3中,甲中的3气体是
和
的混合气体,那么甲中最后剩余的无色气体是,写出
与
反应的化学方程式为。
(4)实验4中,已知:。甲针筒内活塞有移动,针筒内有白烟产生外,气体的颜色变为。最后针筒内剩余气体的体积约为
。
已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是()
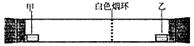
| A. | 甲是浓氨水,乙是浓硫酸 | B. | 甲是浓盐酸,乙是浓氨水 |
| C. | 甲是浓氨水,乙是浓盐酸 | D. | 甲是浓硝酸,乙是浓氨水 |
下列叙述正确的是()
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.与水反应,红热的
与水蒸气反应均能生成碱
C.、
、
分别在足量氧气中燃烧均生成一种相应氧化物
D.、
、
三种固体受热后均能生成气体
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为:
(1)氨催化氧化的化学方程式为:
 (2)原料气中空气必须过量,其主要原因是;
(2)原料气中空气必须过量,其主要原因是;
 (3)将铂铑合金做成薄丝网的主要原因是;
(3)将铂铑合金做成薄丝网的主要原因是;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)