25.6mg铜与含有1.4×10-3molHNO3的浓硝酸恰好完全反应,放出的气体用排四氯化碳液体的方法收集。
(1)其气体的体积在标准状况下多少?(不考虑生成N2O4)。
(2)将收集到的气体倒立于水槽中,向其中通入标准状况下的O2多少毫升,才能使气体全部生成硝酸?
a mol氨完全氧化成HNO3,并且全部溶于反应生成的水中,得HNO3的质量分数约为
| A.78% | B.42% | C.50% | D.63% |
1.92gCu片与定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则反应中消耗HNO3_______mol被还原的HNO3________mol,转移电子________mol。
同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3,②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为 ( )
| A.①>② | B.①<② | C.①=② | D.不能确定 |
在锌跟稀硝酸反应时,若参加反应的锌与消耗的硝酸的物质的量之比为1:2.5时,则被还原的HNO3和未被还原的HNO3的物质的量之比为
| A.2:5 | B.1:4 | C.1:5 | D.1:9 |
在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
① 混合气体由哪些气体组成?它们的各占多少毫升?
② 最后剩余气体是什么气体?
某化学课外小组所做实验的示意图如下图
 |
 图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1)A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(5)当F中为紫色石蕊试液时,见到的现象是 主要
反应方程式
为 、 。
从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2—与O2—都有相当关系,下列有关方程式不正确的是 ( )
| A.NH4Cl+KNH2=KCl+2NH3↑ |
| B.M+2NH3=M(NH2)2+H2↑(M为二价活泼金属) |
| C.2NH4Cl+MNH=MCl2+NH3 |
| D.2NH4Cl+MO=M(NH2)2+2HCl+H2O |
常温下 A 和 B 两种气体组成混合气体(A 的相对分子质量大于 B 的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论 A 和 B 以何种比例混合,氮和氢的质量比总大于 14/3。由此可确定 A 为_____________,B 为____________,其理由是__________________。
若上述混合气体中氮和氢的质量比为 7∶1,则在混合气体中 A 和 B 的物质的量之比为________;A 在混合气体中的体积分数为_____%。
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有
关说法中,不正确的是
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.1molNH5中含有5mol N-H键 |
北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是 。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如右下图 所示),一定没有沉淀生成的是
| |
X |
Y |
Z |
| A |
NO2 |
SO2 |
BaCl2 |
| B |
NH3 |
O2 |
Al2(SO4)3 |
| C |
NH3 |
CO2 |
NaCl(饱和) |
| D |
CO |
O2 |
Ca(OH)2 |

硝酸铵是一种常用的化肥,在高温或撞击下容易发生分解反应而燃炸:
 则下列有关该反应的说法正确的是 ( )
则下列有关该反应的说法正确的是 ( )
| A.氧元素被还原,氮元素被氧化 |
| B.有两种元素的化合价发生了变化 |
| C.生成的气体与转移电子的物质的量之比是10:3; |
| D.该反应的熵变△S<O、焓变△H<0 |
为测定固体磷铵化肥中铵态氮的质量分数,实验室用右图所示装置进行实验。实验时,在A中加入mg磷铵样品,关闭止水夹a,打开止水夹b,向A中加入足量的浓NaOH溶液,完全反应后C中浓硫酸增重ng。请回答下列问题:

(1)试说明检查该装置气密性的操作方法和实验现象: 。
(2)实验过程应该在何时鼓入空气?答: (填“实验开始前”、“反应过程中”或“完全反应后”)
(3)如某次测定的铵态氮的质量分数明显偏低,则可能的原因是 (填字母)。
A.磷铵样品与氢氧化钠未充分反应 B、A和B中残留了一定量的氨气
C.氢氧化钠溶液的浓度太大
(4)某厂利用生产磷铵排放的磷石膏废渣制硫酸联产水泥,硫酸返回用于生产磷铵。其生产流程图如下:


①操作b的名称是浓缩、冷却、 。
②如反应Ⅱ的产物是两种酸式盐,则物质B中溶质的化学式是 。
③若在实验室中对反应Ⅲ产生的气体用NaOH溶液吸收,可使用的装置是
(填字母)。
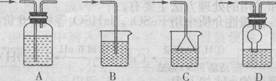
④该生产流程最大的优点是尽可能地实现原料的循环使用和副产物的综合利用,该生产流程体现的基本思想是 。
含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式
____________________ 。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积/mL |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点
是 。
②步骤二中设计色阶序号1的作用
是 。
③如果水样显色后比6号还深,应采取的措施
是 。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3=== NO3- + H+ + H2O 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇 g。