已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是______________
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________
A HCN B HClO C C6H5OH D CH3COOH E H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。
下列物质在常温下发生水解时,对应的水解方程式正确的是
A.Na2 CO3 :CO32- +H2O  2OH- +CO2↑ 2OH- +CO2↑ |
B.NH4 NO3 :NH4+ +H2O  NH3·H2 O+H+ NH3·H2 O+H+ |
C.CuSO4 :Cu2++2H2O  Cu(OH)2↓+2H+ Cu(OH)2↓+2H+ |
| D.KF:F- +H2O=HF+OH- |
下面关于水解应用的说法错误的是
| A.用热水溶解纯碱能够提高去油污的效果 |
| B.配制氯化铁溶液时滴加几滴稀盐酸可以防止氢氧化铁形成 |
| C.硫酸铵和草木灰混合施用到农田可以增强肥效 |
| D.盐碱地(含NaCl、 Na2 CO3)施加适量石膏可以降低土壤的碱性 |
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中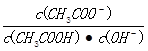 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
下列说法正确的是( )
| A.常温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≤7 |
| B.已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的弱 |
| C.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)>c(Cl-)=c(CH3COOH) |
| D.pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三种溶液物质的量浓度为c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A.V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) |
| B.V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) |
| C.V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) |
| D.对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
99℃时,Kw=1.0×10-12,该温度下测得0.1mol/LNa2A溶液的pH=6。下列说法不正确的是( )
| A.H2A在水溶液中的电离方程式为H2A=2H++A2- |
| B.该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 |
| C.体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A |
| D.将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
下列说法不正确的是( )
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+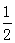 O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
下列说法中正确的是( )
| A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍 |
| B.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的c(H+)的3倍 |
| C.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| D.在25℃时,无论酸性、中性还是碱性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 |
常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是( )
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
| A.①>②>③>④ | B.①>②>④>③ | C.③>④>②>① | D.①=②=③=④ |
工业制备氯化铜时,将浓盐酸用蒸汽加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得到强酸性的混合溶液。现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全沉淀;pH≥6.4时,Cu2+完全沉淀;pH≥3.7时,Fe3+沉淀。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?_______(填“能”或“不能”),理由是________。
(2)有人用强氧化剂Ca(ClO)2将Fe2+氧化为Fe3+:
①加入Ca(ClO)2后,溶液的pH变化是_______(填代号)。
| A.可能减小 | B.一定减小 | C.可能增大 | D.一定增大 |
②你认为用Ca(ClO)2做氧化剂是否妥当?________,理由是______________________。
③现有下列几种常用的氧化剂,适合用于除去混合溶液中Fe2+的有______(有几个选几个,填代号)。
A Cl2 B KMnO4 C 浓HNO3 D O2 E H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(有几个选几个,填代号)。
A Cu2(OH)2CO3 B 氨气 C CuO D Na2CO3 E NaOH F Cu(OH)2
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是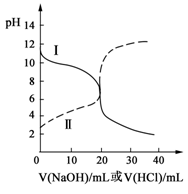
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是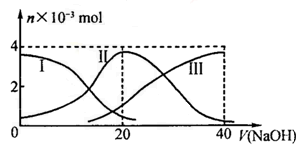
| A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| B.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸 |
| D.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
下列各离子浓度的大小比较,正确的是( )
| A.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.0.01mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)> c(NH4+) > c(Na+) >c(OH-)>c(H+) |
| C.同浓度的下列溶液中:①(NH4)2SO4②NH4HCO3③NH4Cl,④NH3·H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) |
(1)Na2CO3溶液显_______________性,用离子方程式表示其原因为_________________。
(2)常温下,pH=11的NaHCO3溶液中,水电离出来的c(OH-)=_______________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_________mol/L。
(3)已知纯水中存在如下平衡:H2O H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是__________(填字母序号)。
H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是__________(填字母序号)。
| A.向水中加入NaHCO3固体 | B.向水中加入NaHSO4固体 |
| C.加热至100℃ | D.向水中加入(NH4)2SO4固体 |
(4)若将等pH、等体积的NaOH溶液和NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m_______n(填“<”“>”或“=”)。
(5)等物质的量浓度的下列溶液:①NaCl; ②NaOH; ③CH3COOH; ④HCl; ⑤CH3COONa ;⑥NaHCO3;⑦Ba(OH)2;⑧Na2CO3,pH由大到小的顺序为_________(填序号)。