下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O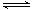 HCOO-+H3O+ HCOO-+H3O+ |
B.HS-+H2O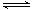 S2-+H3O+ S2-+H3O+ |
C.CO32-+H2O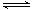 HCO3-+OH- HCO3-+OH- |
D.HCO3-+H2O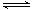 CO32-+H3O+ CO32-+H3O+ |
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 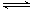 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。
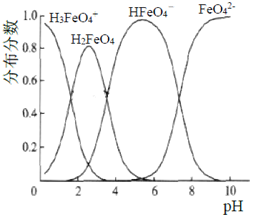
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-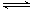 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
| A.c(R2-)+c(OH-)=c(Na+)+c(H+) |
| B.c(R2-)>c(Na+)>c(H+)=c(OH-) |
| C.2c(R2-)+c(HR-)=c(Na+) |
| D.混合后溶液的体积为2a L |
下列实验现象以及结论均合理的是
| A.在一块镀锡铁板刻一划痕,滴加酸化的食盐水浸泡及KSCN溶液,溶液颜色没有变化,判断其具有好的耐腐蚀性 |
| B.测定一定物质的量浓度的某NaA溶液的pH,pH>7,可以说明HA是弱酸 |
| C.在氯化银的悬浊液中加入碘化钠溶液,沉淀颜色不变,说明氯化银的溶解度比碘化银大 |
| D.在酸碱中和滴定中,用标准氢氧化钠溶液测定醋酸溶液的浓度时,用甲基橙做指示剂对滴定终点的判断比用酚酞的更准确 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
碱性锌锰电池比普通锌锰电池性能好 |
锌在碱性介质中被氧化成更高价态 |
| B |
配制FeCl2溶液时加入少量铁粉 |
抑制Fe2+的水解 |
| C |
施肥时,草木灰(有效成分为K2CO3)不能与铵盐氮肥混合使用 |
它们反应生成氨气会降低肥效 |
| D |
纯水和干木头都不导电,但木头用水浸湿后却可以导电 |
水和干木头的某些成分发生化学反应 |
关于浓度均为0.1mol/L的四种溶液:①NH3·H2O、②HCl、③NH4Cl 、④(NH4)2CO3,下列说法正确的是
| A.由水电离出的c(H+):④>③>①>② |
| B.①、②和③等体积混合后的溶液:pH=7 |
| C.c(NH4+):③>④>① |
| D.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.1mol/L |
下列离子方程式正确的是
A.碳酸氢钠水解:HCO3-+ H2O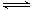 H3O++ CO32- H3O++ CO32- |
B.醋酸铵溶于水:CH3COONH4+ H2O CH3COOH + NH3·H2O CH3COOH + NH3·H2O |
| C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq)=CaCO3(s) + SO42-(aq) |
| D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+ OH-=SO42-+ H2O |
对于0.1mol·L-1的Na2S溶液,下列判断正确的是
| A.向溶液中加入少量NaOH固体,能促进水的电离 |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
25℃时,在10 mL浓度均为0.1mol/L NaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
| A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O) |
| B.加入10 mL盐酸时:c(NH4+) +c(H+) =c(OH-) |
| C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+) |
| D.加入20 mL盐酸时:c(Cl-) =c(NH4+) +c(Na+) |
下列式子属于水解反应,且溶液呈酸性是
A.碳酸氢钠溶于水:HCO3﹣+H2O H3O++CO32﹣ H3O++CO32﹣ |
B.氯化铁溶于水Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
C.硫氢化钠溶于水: HS﹣+H2O H2S+OH﹣ H2S+OH﹣ |
D.甲酸溶于水:HCOOH+H2O HCOO﹣+H3O+ HCOO﹣+H3O+ |
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
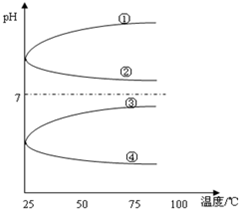
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
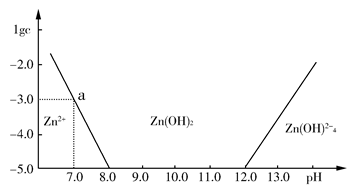
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
25℃时,有下列四种溶液:①0.1mol/L的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的H2SO4溶液;④0.1mol/L的Na2CO3溶液。则下列有关说法中正确的是( )
A.溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| B.在上述四种溶液中,pH由大到小的顺序为:②④①③ |
| C.将该温度下amL的溶液②与bmL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2 |
| D.若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
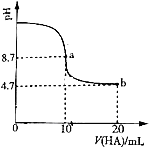
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A—)+c(HA)
D.b点所示溶液中c(A—)>c(HA)
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+ )>c(C1O-)>c(CH3COO- )>c(OH-)>c(H+) |
| B.碳酸钠溶液中滴加少量氯水的离子方程式:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- |
| C.向0.lmol•L-1CH3COOH 溶液中滴加NaOH 溶液至C(CH3COOH) : C(CH3COO-) =9:5,此时溶液pH = 5 |
| D.向浓度均为1×10 3 mol•L- 的KC1和K2Cr04混合液中滴加1×10 3 mol•L- 的AgN03溶液,CrO42-先形成沉淀 |