无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 ;
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
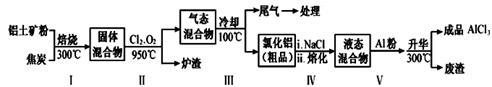
已知:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
FeCl2 |
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种);
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 ;
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1="+1344.1kJ" ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2="+1169.2kJ" ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 ;
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 ;
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
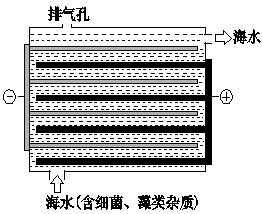
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图。则下列分析正确的是(不计CO2溶解)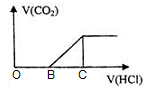
| A.若OB=0,则溶液M为Na2CO3溶液 |
| B.若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2 → HCO3- |
| C.若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC |
| D.若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。
完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___________________________。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式________。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是_________________。向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐_____________(填“变大”、“变小”),生成的沉淀是_____________;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___________。
a.c(Na+) = c(S2O32-) + 2 c(HSO3-) + 2c(H2SO3) + 2 c(HS-)
b.c(Na+) + c(H+) =" 2" c(S2O32-) + c(HSO3-) + c(HS-) + c(OH-)
c.c(Na+) =" 2" c(HS-)
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
| A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3) |
| B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) |
| C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3 |
| D.结合H+的能力:Y- > CO32- > X- > HCO3- |
常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是
| A.氢氧化钠溶液 | B.通入二氧化碳 | C.氢氧化钙溶液 | D.盐酸 |
已知25℃时,几种弱酸的电离常数如下,下列说法不正确的是( )
| 弱酸的化学式 |
CH3COOH |
HClO |
H2CO3 |
| 电离常数 |
1.8×10-5 |
2.9×10-8 |
K1= 4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液①c(CH3COONa)②c(NaClO) ③c(NaHCO3)④c(Na2CO3)
pH关系为:④>②>③>①
B.少量CO2通入次氯酸钠溶液中:CO2+ClO-+H2O=HClO +HCO3-
C.新制氯水中Cl2+H2O HCl+HClO为适当增大HClO 的浓度,可加入少量固体NaHCO3
HCl+HClO为适当增大HClO 的浓度,可加入少量固体NaHCO3
D.某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L
常温下,下列溶液中各微粒的物质的量浓度关系正确的是( )
| A.浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) |
| B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| C.NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) |
| D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO) + c(ClO-)= c(HCO3-) + c(H2CO3) + c(CO32-) |
水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
某二元酸(化学式H2B)在水中的电离方程式为H2B=H++HB-;HB- H++B2-,则在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-,则在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)=2c(B2-)+c(HB-)
下列操作会促进H2O的电离,且使溶液pH>7的是:
| A.将纯水加热到90 ℃ | B.向水中加少量Na2CO3固体 |
| C.向水中加少量NaOH固体 | D.向水中加少量FeCl3固体 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A.物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③ |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时 c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.将lmolNaClO和2molNaHCO3配制成1L混合溶液:c(HClO)+c(ClO-)=2c(HClO3-)+2c(H2CO3)+2c(CO32-) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则溶液中: |
C(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)="c" (A-)+c (OH-) + c(HA)
NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂。
(1)NaHCO3俗称 ,其水溶液显碱性的原因是(用离子方程式表示) 。
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式___________________________。
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出。
①倒置灭火器时发生反应的离子方程式是___________________________;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液。你认为此建议_______(填“合理” 或“不合理”),理由是__________________。
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
①该混合物中NaHCO3的物质的量分数为 ;
②所用盐酸的物质的量浓度是 mol·L-1。