常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO4-==2X2++5Z2+8H2O ②2A2++B2==2A3++2B-
③2B-+Z2==B2+2Z- 由此判断下列说法正确的是( )
| A.反应Z2+2A2+==2A3++2Z-不能进行 |
| B.Z元素在①③反应中均被氧化 |
| C.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
| D.氧化性由弱到强的顺序是XO4-、Z2、B2、A3+ |
金属铜能被氯化铁浓溶液腐蚀,其化学反应是:Cu+2FeCl3=CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为 , 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为 。
(3)充分反应后溶液中一定不存在的金属离子为 。
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小: 。
(5)试计算最后溶液中Fe2+离子的物质的量浓度 mol/L
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。有关说法不正确的是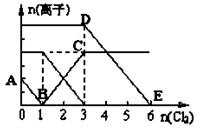
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)= 6 mol/L |
| C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
| D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
比较是化学学习中的一种重要方法。下列各组比较中不正确的是
| A.在相同条件下的溶解度:NaHCO3>Na2CO3 |
| B.还原性:I->Br->Cl->F- |
| C.氧化性:F2> Cl2 > Br2>I2 |
| D.碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序为
①I2 + SO2 + 2H2O = H2SO4 + 2HI
②2FeCl2 + Cl2 = 2FeCl3
③2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl
| A.I-> Fe2+>Cl->SO2 | B.Cl-> Fe2+> SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I-> Fe2+>Cl- |
下列变化,必须要加入氧化剂才能实现的是
| A. HCl→H2 | B. H2O2→O2 | C. H2SO4→SO2 | D. Fe→Fe3O4 |
常温下,在溶液中可发生以下反应:①2Fe2++ Br2= 2Fe3+ + 2Br-,
②2Br-+ Cl2=Br2 + 2Cl-, ③2Fe3+ + 2I-= 2Fe2++ I2;由此判断下列说法错误的是
| A.铁元素在反应①中被氧化,在③中被还原 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ |
| D.还原性强弱顺序为:I- > Fe2+ > Br- > Cl- |
己知反应:① PbO2+4HCl=PbCl2+ C12↑+2H2O,②Cu+2Fe3+=Cu2++2Fe2+,③C12↑+2Fe2+="2" Fe3++2Cl-。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>PbO2 | B.PbO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>PbO2>Cl2 | D.Cu2+>Fe3+> Cl2>PbO2 |
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
XeF4在水中发生反应:6XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑下列判断中正确的是
| A.XeF4分子具有非常好的热稳定性 |
| B.XeF4分子中Xe的化合价为0价 |
| C.氧化剂和还原剂的物质的量之比为2:3 |
| D.每生成4 molXe转移16 mol电子 |
高锰酸钾制氯气:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 地康法制氯气:4HCl+O2 2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl
2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl MnCl2+Cl2↑+2H2O 下列说法正确的是
MnCl2+Cl2↑+2H2O 下列说法正确的是
| A.实验室常用地康法制氯气 |
| B.氧化性强弱顺序是O2>KMnO4>MnO2 |
| C.氧化性强弱顺序是KMnO4>O2>MnO2 |
| D.氧化性强弱顺序是KMnO4>MnO2>O2 |
下列反应中,硝酸既表现酸性,又表现氧化性的是
| A.Fe2O3跟稀硝酸反应 |
| B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 |
| D.Al(OH)3跟稀硝酸反应 |
Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L