能正确表示下列反应的离子方程式是
A.硫氢化钠的水解反应 HS-+ H2O  S2-+H3O+ S2-+H3O+ |
| B.碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32- |
| C.Na2O2与H2O反应制备O2 Na2O2 + H2O = 2Na+ + 2OH-+ O2↑ |
| D.向碳酸钠溶液中加少量盐酸 CO32-+2H+ = H2O+CO2↑ |
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH溶液的锥形瓶中,锥形瓶中发生反应的离子方程式为________________。
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)仪器X的名称是___________;分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaClO混合溶液
B.CO(NH2)2溶液
选择的理由是_____________________________。
实验三:测定馏分中水合肼的质量分数
水合肼具有还原性,被氧化生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25.00 mL溶液于锥形瓶中,加入10 mL水,摇匀。
c.用0.2000 mol·L-1碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为_________________________________;
测定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是______________________。
(4)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00 mL,则馏分中水合肼(N2H4·H2O)的质量分数为________(保留三位有效数字)。
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:
(1)写出化学式:A________,B_________,D_________E_______。
(2)以上反应中不属于氧化还原反应的有______________(填序号)。
(3)写出反应②④⑥的化学方程式:
②_______________________________。
④_______________________________。
⑥_______________________________。
(4)写出反应⑤的离子方程式:_____________________,写出铝粉和C溶液反应的离子方程式:___________________
下列离子方程式书写正确的是( )
| A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O |
| B.往CuCl2溶液中加入钠 2Na+Cu2+=2Na++Cu |
| C.铁与稀硫酸反应 Fe+2H+= Fe2++H2↑ |
| D.稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-= H2O +BaSO4↓ |
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
NH4+、Fe2+、SO42- |
少量Ba(OH)2溶液 |
2NH4++SO42-+Ba2++2OH-===BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO3-、Cl- |
过量NaOH溶液 |
Mg2++2HCO3-+4OH-=== 2H2O+Mg(OH)2↓+2CO32- |
| C |
K+、NH3·H2O、CO32- |
通入少量CO2 |
2OH-+CO2===CO32-+H2O |
| D |
Fe2+、NO3-、SO32- |
NaHSO4溶液 |
SO32-+2H+===SO2↑+H2O |
已知:溶液E焰色反应为黄色。
根据以上转化关系,回答下列问题:
(1)写出下面物质的化学式:
A______________,B____________,C_______________,D_____________。
(2)写出下列离子方程式:
(Ⅰ)___________________________;
(Ⅱ)___________________________;
(Ⅲ)___________________________;
(Ⅳ)_______________________________。
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按图所示进行实验: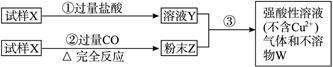
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为______________(用m表示)。
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:

(1)写出化学式:A C
(2)写出反应①②④的方程式。
①离子方程式
②通入过量二氧化碳时离子方程式
④化学方程式
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
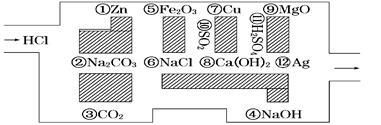
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(3)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(4)写出氧化铝与④反应的化学方程式 ,氧化铝属于 ____________氧化物(填“酸性”“碱性”或“两性”)。
下列反应的离子方程式正确的是
| A.Na2O2溶于水中:Na2O2+H2O═2Na++2OH-+O2↑ |
| B.用FeC13溶液腐蚀电路板:Cu+Fe3+═Cu2++Fe2+ |
| C.向NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O═Al(OH)3+HCO3- |
| D.CaCO3与盐酸反应: CO32-+2H+═CO2↑+H2O |
A、B、C、D、E五种物质的焰色都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式: B ,E 。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目: 。
(3)写出C→D的离子方程式: 。
(4)写出化学方程式:H2O+B→: 。
现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡。根据要求回答下列问题:
(1)下图为常见物质的树状分类图:
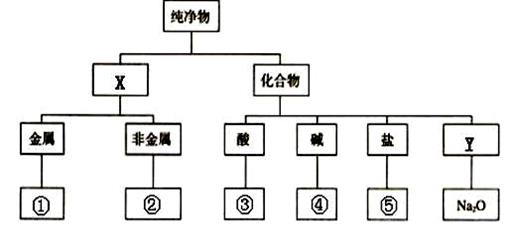
X属于_________(填物质类属);若图中①—⑤分别代表上述五种物质,则④对应的化学式是 。
(2)上述五种物质中,有一种物质能与其他三种物质发生反应。该物质是__________。
(3)上述五种物质间发生置换反应的离子方程式____________________
(4)写出过量的③与④反应的离子方程式 ____________________
下列反应的离子方程式正确的是
①碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
②铁跟稀盐酸反应:Fe+2H+===Fe2++H2↑
③碘化钾溶液跟适量溴水反应:I-+Br2===2Br-+I
④铁跟硫酸铜反应:Cu2++Fe===Fe2++Cu
⑤碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO3-+OH-===CaCO3↓+H2O
| A.①② | B.②⑤ | C.③④ | D.②④ |
限用H2SO4、HNO3、CH3COOH、以及NaOH、Ba(OH)2、Cu(OH)2在水溶液中进行反应,符合离子方程式H+ + OH- =H2O的化学方程式的个数有( )个
| A.3 | B.4 | C.5 | D.6 |
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),