亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
某化工厂以软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,可得到含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液,其中发生的主要反应之一如下,请配平此反应方程式:_____MnO2+_____FeS+_____H2SO4=_____MnSO4+_____Fe2(SO4)3+_____S+_____H2O
(2)将所得溶液按以下的工业流程(如图I)进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn. 图(Ⅰ)
图(Ⅰ)
a.操作①中加Zn粉后发生反应的离子方程式为_________________;
b.操作②中加入适量X的作用是_________________;
c.工业上用惰性电极电解溶液(IV)获得产品,请写出电解过程中的阳极反应式_________________;
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程如图(Ⅱ)。 图(Ⅱ)
图(Ⅱ)
a.AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为_________________;
b.若得到n molAl(OH)3,则理论上消耗的NaOH和HCl的物质的量分别为___________、__________;
下列与NaHSO3溶液有关的离子方程式书写错误的是
| A.NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O=SO42-+2Fe2++3H+ |
| B.NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-=CaSO3↓+H2O |
| C.NaHSO3溶液和稀HNO3反应:HSO3-+H+=SO2↑+H2O |
| D.NaHSO3溶液和NaAlO2溶液反应:HSO3-+ AlO2-+H2O=SO32-+Al(OH)3↓ |
从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)图中A的化学式为____________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。
(2)海水淡化处理的方法有______________________________。(写出3种即可)
(3)过程⑤的化学方程式为_________________________。
(4)从B溶液制备B的无水晶体的“操作a”为_____________________。
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 ______________________________。
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是_____ 。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。

请回答下列问题:
(1)沉淀K为 ,由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是__________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与02的物质的量之比为______________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMn04溶液
⑥氯水和KSCN的混合溶液
下列离子方程式与所述事实相符且正确的是
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
C.以铜为电极电解饱和食盐水:2 Cl-+2H2O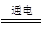 Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2 |
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
下列有关离子方程式,正确的是
| A.稀硝酸和过量的铁屑反应:Fe+4H++ NO3-=Fe3++NO↑+2H2O |
B.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH- NH3+CO32-+2H2O NH3+CO32-+2H2O |
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VI A族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 (用元素符号表示)。SeO3分子的立体构型为 。
(3)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。

(4)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(5)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
下列离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]- + 4NH4+ |
| B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O |
| D.碘化亚铁中通入氯气:2I-+ Cl2=I2+ 2Cl- |
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2.装置①中发生反应的化学方程式是__________________________;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请写出有关反应的化学方程式_________________________;
(2)SO3常温下是液体,16.8℃以下是无色或白色晶体。乙同学利用此套装置合成SO3,其反应为2SO2+O2 2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是__________________________;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2L N2,则NO的转化率(转化率=已转化的量/原来的总量)是______________(能正确表达出计算过程即可)。
按要求写出下列反应的化学方程式或离子方程式:
(1)硝酸见光分解的化学方程式__________________________;
(2)氨的催化氧化反应的化学方程式__________________________;
(3)锌与稀硝酸按物质的量比2:5反应的离子方程式__________________________;
(4)NaHCO3溶液与少量Ca(OH)2溶液反应的离子方程式__________________________;
(5)Cu2S与稀硝酸反应产生硝酸铜、硫酸、一氧化氮和水的化学方程式__________________________;
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空:
(1)上述分类中,分成A、B两组的依据是____________________;
(2)C组物质与水反应的离子方程式为____________________;
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有____________________;
下列离子方程式不正确的是
| A.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B.次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+=CaSO3↓ |
C.NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-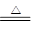 CO32-+NH3↑+2H2O CO32-+NH3↑+2H2O |
| D.硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O |