已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请下列问题:
(1)写出NaHSO4在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,则反应的离子方程式是 。
(4)若将NaHSO4溶液逐滴滴入Fe(OH)3胶体溶液可观察到的现象是 。
下列指定反应的离子方程式正确的是
| A.Cu溶于稀HNO3:Cu+2H++NO3-===Cu2++NO2↑+H2O |
| B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓ |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O===Al(OH)3↓+HCO3- |
下列离子方程式的书写正确的是
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
| B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3-= CO32-+ H2O |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH-= Al(OH)3↓ |
| D.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: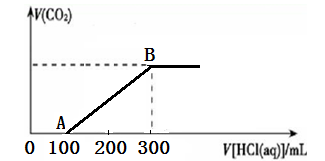
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液
| A.①④ | B.②③④ | C.②③ | D.①③④ |
将过量的CO2分别通入下列溶液中,最终有沉淀析出的溶液是
①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液
| A.①②③④ | B.只有②④ | C.只有①②③ | D.只有②③ |
下列离子方程式书写正确的是
| A.金属铝投入到氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓ |
| C.三氯化铁溶液中加入铁粉 Fe3++Fe = 2Fe2+ |
D.二氧化碳通入碳酸钠溶液中: |
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)写出该实验中产生氢气的离子方程式并用单线桥表示电子转移的方向和数目:_______________。
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)请选择必要的装置,按气流方向连接顺序为________________(填仪器接口的字母编号)。
(4)实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,于是甲同学判断上述实验中确有CaH2生成。请根据甲同学的现象写出CaH2与水反应的化学方程式______________________。乙同学发现将单质钙加入水中也能发生上述现象,因此乙同学认为不能证明确有CaH2产生,请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______________________。
下列离子方程式中,正确的是
| A.盐酸滴在大理石上:2H++ CO2-3=CO2↑+H2O |
| B.硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| C.向NaOH溶液中通入过量CO2:OH-+CO2=HCO3- |
| D.氢氧化钠与NaHCO3溶液反应: OH-+ H+= H2O |
Ⅰ.在MgCl2溶液中滴入NaOH溶液,会有白色沉淀出现,该白色沉淀不能溶解于过量的氢氧化钠中。反应的离子方程式是 ;但Al(OH)3却能溶解在过量NaOH溶液中,该反应的离子方程式是 。
Ⅱ.在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示。
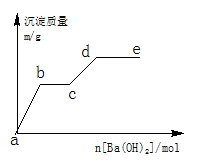
(1)a→b过程中发生反应的离子方程式是
(2)b→c发生反应的离子方程式是
(3)d点沉淀质量是 g。
下列离子方程式书写正确的是
| A.将大理石投入到足量盐酸中: CO32-+2H+=CO2↑+H2O |
| B.铁钉放入硫酸铁溶液中: Fe+Fe3+ = 2Fe2+ |
| C.向AlCl3溶液中加入过量的氨水反应:Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+ |
| D.将稀硫酸滴入氢氧化钡溶液中:Ba2+ + SO42- =BaSO4↓ |
下列化学表达式正确的是
| A.NaHCO3 = Na+ + H+ + CO32- |
| B.Na + 2H2O = Na+ + 2OH-+ H2↑ |
| C.2Fe + 6H+ = Fe3+ + 3H2↑ |
| D.NaHSO4 = Na+ + H+ + SO42- |
下列反应的离子方程式正确的是
| A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
| C.用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3- |
| D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ |
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 ;其水溶液中离子浓度由大到小的顺序是 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式 。