能正确表示下列化学反应的离子方程式的是 ( )
| A.盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O |
| B.稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
| D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
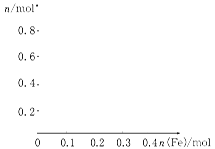
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )。
A. |
B. |
| C.n=m+0.017Vc | D.n=p+ ×2 ×2 |
下列离子方程式正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C.氯化铝溶液加入氨水:Al3++3OH-=Al(OH)3↓ |
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH― NH3↑+H2O NH3↑+H2O |
下列反应的离子方程式正确的是( )
| A.铁和稀盐酸反应2Fe+6H+=2Fe3++3H2↑ |
| B.碳酸钙溶于稀盐酸中 CO32-+2H+=CO2↑+H2O |
| C.碳酸氢钠溶液与盐酸反应HCO3-+H+=CO2↑+H2O |
| D.氧化铜与盐酸反应 O2―+2H+=H2O |
将铜粉放入稀硫酸中,加热无明显反应,但加入某一种盐后,发现铜粉质量逐渐减少,该盐可能是( )
①硫酸亚铁 ②硫酸锌 ③硝酸钾 ④氯化钠 ⑤氯化铁
| A.①③ | B.③⑤ | C.②③ | D.②④ |
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_____ ____。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式______________________________。
(3)反应②的离子方程式_______________________________。
(4)F→G的化学方程式_________________________________。
将镁、铝的混合物共0.2 mol,溶于200mL 4mol/L的盐酸溶液中,然后再滴加2 mol/L 的NaOH溶液。请回答下列问题:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Al)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol/L的硫酸溶解此混合物后,再加入840mL 2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。则a的取值范围为 。
下列事实、离子方程式及其对应关系均正确的是
A.向Ag2S 浊液中滴加少量稀NaCl 溶液,黑色沉淀逐渐变成白色: Ag2S +Cl- AgCl +S2- AgCl +S2- |
| B.向K2Cr2O7 溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝: 4H+ + 4I- + O2= 2I2 + 2H2O |
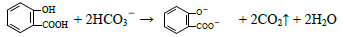
D.向水杨酸(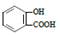 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
下列离子方程式书写正确的是
| A.氯气通入水中 H2O+Cl2=2H++Cl-+ClO - |
| B.碳酸钙加入盐酸中CO32-+2H+=CO2↑+H2O |
| C.氯化铁溶液中加入铁粉2Fe3++Fe=3Fe2+ |
| D.铜片加入稀硝酸中Cu+2H+=Cu2++H2↑ |
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
| A.若管道漏气遇NH3就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
将a g Fe2O3、Al2O3样品溶解在过量的200 mL浓度为0.1 mol·L-1的盐酸溶液中,然后向其中加入NaOH溶液,使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为( )
| A.0.1 mol·L-1 | B.0.2 mol·L-1 | C.0.4 mol·L-1 | D.0.8 mol·L-1 |
浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )[
| A.BaCl2 NaOH NaHCO3 | B.Na2CO3 MgCl2 H2SO4 |
| C.AlCl3 NH3·H2O NaOH | D.Ba(OH)2 CaCl2 Na2SO4 |