根据物质结构和元素周期表进行分析判断,下列叙述不正确的是( )
| A.第15列元素的最高价氧化物为R2O5 |
| B.第三周期元素的离子半径,从左到右逐渐减小 |
| C.同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1或11或25 |
| D.只含有非金属元素的化合物不一定是共价化合物 |
医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是( )
| A.53135I是碘的一种同素异形体 | B.53135I是一种新发现的元素 |
| C.53135I位于元素周期表中第四周期ⅦA族 | D.53135I核内的中子数与核外电子数之差为29 |
下表是元素周期表的一部分,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
① |
② |
③ |
④ |
|
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
11 |
12 |
(1)写出①元素的名称
(2)写出⑨元素的符号
(3)在这些元素中, (用元素符号填写,下同)是最活泼的金属元素; 是最活泼的非金属元素; 是最不活泼的元素。
(4)这些元素的最高价氧化物的对应水化物中 酸性最强; 碱性最强;
(5)从⑤到⑪的元素中, 原子半径最小。
(6)比较⑤和⑥的化学性质,更活泼,试用实验证明此现象(简述操作、现象和结论)
。
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)ⅡA族元素的最外层电子数________; (2)第3周期元素的最高化合价________;
(3)F-、Na+、Mg2+、Al3+的离子半径________。
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.原子半径:A<B<C<D<E
B.金属性:D>C
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
核反应可以提供很高能量,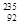 U是重要的核工业原料,在自然界的含量很低。
U是重要的核工业原料,在自然界的含量很低。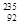 U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关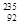 U说法正确的是
U说法正确的是
A.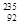 U与 U与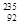 U互为同位素 U互为同位素 |
B.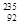 U与 U与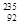 U互为同素异形体 U互为同素异形体 |
C.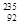 U原子核中含有92个中子 U原子核中含有92个中子 |
D.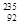 U原子核外有143个电子 U原子核外有143个电子 |
下列说法正确的是
| A.Li是最活泼金属元素,F是最活泼非金属元素 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 |
| D.X2+的核外电子数目为10, 则X在第3周期第ⅡA族 |
科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为
| A.同种物质 | B.同分异构体 | C.同素异形体 | D.同位素 |
某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
| A.X2+具有还原性 | B.X的+2价化合物比+4价化合物稳定 |
| C.XO2具有强氧化性 | D.该元素是第ⅡA族元素 |
下列各种微粒的表示方法中,不正确的是
| A.碳-12的原子符号:126C | B.次氯酸分子的结构式:H—O—Cl |
| C.硫离子的电子排布式为:1s22s22p63s23p6 | D.二氧化硅的分子式:SiO2 |
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。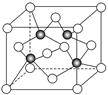
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为: 。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的
外围电子排布是4s24p4,该元素的名称是 。
(3)根据VSEPR模型,H3O+的分子立体结构为: 。
(4)含有非极性键的离子化合物(任写一种) 。
(5)含有极性键和非极性键的极性分子(任写一种) 。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是 .