氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产二水化钙(
)的流程如下。原料石灰石中含有杂质主要是
。
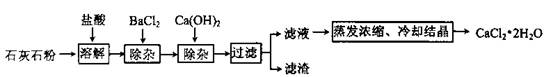
(1)石灰石粉溶解时,
发生反应的化学方程式为。
(2)加入
除去的杂质离子是;加入
除去的杂质离子是。
(3)检验"滤液"酸碱性,如果显碱性,还需加入适量的(填化学式)提高产品纯度。
孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
请回答下列问题:
(1)气体E的化学式是 。
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、 和干燥等操作。
(3)写出孔雀石主要成分与稀硫酸反应的化学方程式: 。
构建知识网络是一种重要的学习方法。如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
(1)C物质的化学式为 。
(2)B物质的一种用途是 。
(3)反应②还需要的一种反应物是 (填化学式)。
(4)写出④反应的化学方程式: 。
(5)反应①导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法。这两种方法的共同原理是阻止钢铁与 接触。
(6)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的
发生反应转化为氯化亚铁,起到补血的作用。
甲同学对有关盐的知识进行了以下的整理。

(1)上述盐的排列是依据顺序归纳整理的。
(2)上述盐因组成上相似而具有某些共同的化学性质,如都能与
溶液反应生成硫酸钡沉淀,该反应的化学方程式为(任选其中一种盐即可)。
(3)甲同学通过查阅资料,发现许多反应都有盐类物质生成。他将这些知识间相互关系整理成右图,请将右图补充完整
,
。
(4)乙同学提出可用如图指导进行物质的制备:请写出2个有关硫酸亚铁生成的化学反应方程式。

答:;
。
下图为某些物质间的转化关系,其中A是白色固体,甲是黑色固体,B为气体单质、C和乙在常温下均为无色液体,E为最常用的金属单质之一,H是一种红褐色沉淀。(部分反应物、生成物、反应条件已略去)
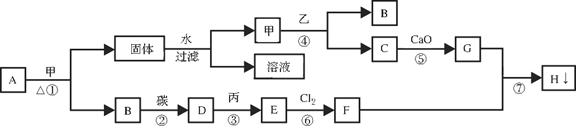
(1)物质D的化学式;
(2)甲在反应①中所起的作用是;
(3)举出防止E的制品锈蚀的一种方法;
(4)写出下列反应的化学方程式
①;
⑤;
⑦。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO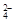 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(4)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO(次氯酸钠)的消毒液,其反应的化学方程式是 。(已知碳酸的酸性强于次氯酸HClO)。
氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质。今年以来,化工原料市场供不应求,各种化工原料价格持续上扬。某化工厂为了增加效益,计划将一批库存的氢氧化钠投入市场。如果你是质检员,请你按以下方案抽取样品对该批氢氧化钠进行检验,看是否变质。
【实验方案】

【推断和结论】
(1)若现象
为有气泡产生,则加入的
溶液可能是,说明氢氧化钠已经变质。
(2)为了进一步探究该产品变质的程度,再取少量样品,加入的
是过量的
溶液(
溶液呈中性),现象
为有白色沉淀,现象
为无色酚酞试液变红色,则证明该批产品(填"部分"或"完全")变质。
【反 思】久置的氢氧化钠变质的原因是(用化学方程式表示).
有一包固体粉末,可能是
、
、
、
中的一种或几种组成,为了分析固体粉末的成分,取少量该固体粉末进行实验,实验方案设计如下:

(1)固体粉末中一定有,一定没有。
(2)若现象
为"沉淀不溶解"或"沉淀部分溶解",结论是固体粉末中;若现象
为"沉淀全部溶解",结论是固体粉末中。
(3)实验步骤①和③都有相同的实验操作,该操作名称为。
(4)写出实验步骤②的化学方程式。
(5)简单修改上述实验方案,可取消第④步实验,修改的方法是.
某兴趣小组对一种废水溶液按如下步骤进行实验:

根据实验推断(假设能发生的反应均恰好完全反应,且微溶物看作可溶物)。
(1)当废水溶液中仅含有一种溶质时,该溶质是(写化学式,下同)。
(2)当废水溶液中含有多种溶质时,除上述(1)中溶质外,还可能存在的溶质是、、、、。
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,右图是它们之间的相互转化关系。回答下列问题:

(1)请推断:B是;E是。
(2)右图转化中产生无色气体E的原因是。
(3)写出物质C与X溶液中某种溶质反应有 A生成的化学方程式:
南京市国民经济和社会发展第“十二五”规划纲要指出,要做强做优电子信息等工业支柱产业.硅(Si)是信息技术的关键材料,常用以下方法制得纯硅,如下图所示:
(1)图中①、③发生了置换反应,②发生了化合反应.写出②和③的化学反应方程式:
②___________________;
③___________________.
(2)完成一种表示置换反应的通式:单质(I)+化合物(I)=单质(Ⅱ)+________.
根据已学知识填表:
| |
单质(I) |
单质(Ⅱ) |
相应的置换反应的化学方程式(各举一例) |
| A |
金属 |
非金属 |
|
| B |
金属(I) |
金属(Ⅱ) |
|
| C |
非金属 |
金属 |
|
| D |
|
|
SiO2+2C高温、电炉Si+2CO↑ |
一包白色粉末可能含有 、 、 、 、 、 中的一种或几种,为判断其组成,进行如下实验:①取少量该白色粉末溶于水,产生白色沉淀,上层清液为无色;②取上层清液滴在pH试纸上,pH>7;③过滤,往得到的白色沉淀中滴入稀盐酸,白色沉淀部分溶解。则该白色粉末中一定含有,一定没有,可能含有。
(8分)现有一包固体混合物,可能含有Na2SO4、Na2CO3、NaCl、NaNO3中的两种或两种以上。小红想知道混合物的成分,便和实验小组同学共同设计完成了以下实验。A的溶液常用作干燥剂。
(1)写出A、B、D的化学式A________;B____________;D________。
(2)向样品溶液中加入A的稀溶液,所发生反应的化学方程式__________________,反应的
基本类型是________。
(3)实验结束了,小红得知混合物的组成可能是①__________;②__________;③__________。
有一无色溶液,已知其溶质是由H2SO4、BaCl2、CuSO4、Na2CO3、KCl、HCl、MgCl2等七种化合物中的两种组成。对该溶液进行相关实验,得出以下实验现象和结论:
①用pH试纸测试,溶液的pH为1;
②加入过量的氢氧化钠溶液,没有沉淀生成。
请根据上述实验现象或结论确定该溶液有可能的组成是:(以下空格可以填满)
、 、 、 、 。