有下列三个化学方程式:
 ① 2Mg + O2 2MgO ② 2H2 + O2 2H2O ③ 2CO + O2 2CO2
① 2Mg + O2 2MgO ② 2H2 + O2 2H2O ③ 2CO + O2 2CO2
(1)通过比较,发现它们有许多共同点:请你写出其中两点:
(2)以上化学方程式也有许多不同之处,请你写出其中一个与另两个的一点不同之处
根据题意回答问题:
(1)用质量守恒定律解释:镁带燃烧后生成物的质量增加。
(2)若用镁带燃烧来验证质量守恒定律,应如何改进实验装置?
如图是空气中氧气含量的测定装置。试回答:
(1)盛在仪器A中的物质常用红磷,反应的现象是 (46) 。 该该反应的文字表达式和化学式为 (47)
(2)该实验得到的结论是 (48) 。
(3)实验中,测得氧气的体积分数偏小的原因可能有(至少回答2
条) (49) 、 (50) 。
(4)如果把A中的红磷换成木炭,请问如何改进这个实验使之成功呢?
| 改进方案 |
改进原理 |
| (51) |
(52) |
木炭燃烧反应的文字表达式和化学式为 (53)
请回答下列有关金属的问题。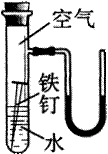
(1) 铝是活泼金属,为什么通常铝锅却很耐腐蚀?
铝是活泼金属,为什么通常铝锅却很耐腐蚀?
(2)右边是某探究实验装置图。一段时间后,能观察到什么现象?
(装置气密性良好,且开始时U型管两端的红墨水液面相平)
(3)X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将X和Z浸入硝酸银溶液中,X表面有银析出而Z无变化。
①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
②具体确定一种X后,写出X与硝酸银溶液反应的化学方程式。
许多因素会影响化学反应速率。请分析下列实验或事实,分别说明在其他
条件不变时,这些因素是如何影响化学反应速率的。示例:硫在纯氧中燃烧比在空气中进
行得更快,更剧烈。答:增大反应物浓度,可以加快化学反应速率。
(1)同种食品在夏天比冬天更容易变质。
(2)过氧化氢溶液在常温下能缓慢分解,若加入少量Mn02时分解加速。
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完。
小明将氢氧化钠溶液与硝酸钡溶液混合,发现无明显现象。一段时间后,
他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请解释可能的原因。
铜(Cu)在空气中长时间暴露于空气中会与空气中的氧气和空气中另外两种常见物质发生化学反应而生成铜绿〔化学式为Cu2(OH)2CO3〕。
(1)请判断,生成铜绿时,参加反应的空气中的另外两种物质是什么?
(2)请判断,铜生成铜绿后,质量会增加、减少还是不变?为什么?
工业上采用电解饱和食盐水制备氢氧化钠: 。因饱和食盐水中混有一定量的 ,在电解时会引起爆炸。为除去 ,工业上常利用电解后的碱性废液、 与 反应(其中 与 化学计量数分别为3、2),使 转化 。该反应的化学方程式为:,请说出此方法的优点之一。
仔细观察右图后回答:

(1)该图反映的环境问题是;
(2)请你提出一条合理化建议。
某兴趣小组对氢氧化钠固体暴露在空气中的变质情况进行了研究。把一小块固体氢氧化钠放在表面皿里,长时间暴露在空气中,发现其固体表面逐渐湿润,部分溶化成液体后又逐渐形成晶体,最终变成粉末。请回答兴趣小组产生的下列问题:

(1)实验室中,氢氧化钠固体应怎样保存?。
(2)氢氧化钠固体暴露在空气中,表面容易变湿,主要原因是什么?。
(3)氢氧化钠固体长期暴露在空气中,最终产物主要是什么。
(4)用酚酞试液(填"能"或"不能")检验氢氧化钠变质。为什。
(5)除加酸以外,怎样用其他方法检验氢氧化钠固体已经变质?。
(6)为了检验氢氧化钠是否已经全部变质,兴趣小组中小薇同学设计了如下实验方案:
准确称取一定质量的变质固体样品,放在右图所示装置中,然后从分液漏斗中加入足量的盐酸,用排水法收集产生的二氧化碳,根据二氧化碳的体积和密度计算变质产物的质量,确定是否全部变质。
①你认为这个方案(填"行"或"不行")。理由是什么?。
②请你另外设计一个方案,并简要说明实验方法和结论。,。
某校化学兴趣小组的同学们帮助实验老师整理化学药品室时,发现两个未贴
标签的试剂瓶中分别存放银白色金属片。到底它们是哪两种金属?请同学们设计实验方案对这两种金属
、
的金属活动性顺序进行实验探究。
(1)进行实验,获得结论。完成好如下实验报告,并回答后续有关问题。
| 实 验 步 骤 |
实 验 现 象 |
结 论 |
| 分别把这两种金属放入溶液中,观察。 |
金属
表面无明显变化;金属
的表面有大量气泡冒出。将燃着的木条放在金属
的试管口,气体燃烧。 |
金属活动性顺序: |
(2)在进行上述实验之前,实验老师只知道
、
可能是锌银中的各一种,则根据实验结果说明Y就是。
(3)小明同学提出,还可以用其它方法证明
、
的活动性。请你帮他补充完整:
。