有三种元素
、
、
,已知
元素的离子
结构示意图为: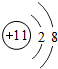 ;
元素原子核内只有一个质子,
元素和
元素组成一种氧化物,该氧化物是常用的溶剂.
;
元素原子核内只有一个质子,
元素和
元素组成一种氧化物,该氧化物是常用的溶剂.
(1)
、
、
三种元素可组成一种化合物
,
的化学式是;这种化合物的俗名是(只填一种);
(2)化合物
溶于水所得溶液的
(填"大于"、"小于"或"等于"):化合物
曝露在空气中容易吸收水分,表面
(3)将一种硫酸盐溶液加入到化合物 的溶液中发生反应,有一种蓝色的沉淀生成,写出这一反应的化学方程式:.
(5分)A~H是初中化学常见的物质,A和C的组成元素相同;B为单质;D为常见的碱,俗称熟石灰;E为一种常见的建筑材料.它们的相互转化关系如图所示(反应条件、部分生成物已略去)。
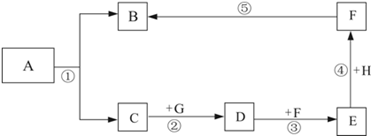
(1)写出下列物质的化学式为:A ; B ; F 。
(2)请写出第③步的化学方程式: 。
(3)反应⑤在实际中的意义是 。
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液之间能否发生反应,将表中内容补充完整.
| 氢氧化钠溶液 |
氯化钠溶液 |
碳酸钾溶液 |
硝酸钡溶液 |
|
| 稀硫酸 |
能反应 |
不能反应 |
能反应 |
|
| 判断依据 |
有水生成 |
没有水、气体、沉淀生成 |
【提出问题】稀硫酸与氢氧化钠溶液的反应没有观察到明显现象,是否真的发生了反应?
【实验方案】小丽同学设计实验方案进行探究,证明氢氧化钠溶液与稀硫酸发生了反应,请你和她一起完成实验报告.
| 实验操作 |
实验现象 |
| ①向试管中加入约2稀氢氧化钠溶液,滴加2滴溶液 |
|
| ②向①所得液体中滴加过量稀硫酸 |
【实验结论】稀硫酸与氢氧化钠溶液发生了反应;
【实验拓展】小丽结合所学知识,认为初中常见的酸碱之间一定能发生复分解反应,她判断的依据是.
有一包固体,可能由氯化铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验: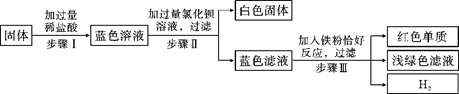
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生。请回答下列问题
(1)原固体中一定含有的物质是___________。
(2)原固体中一定不含有的物质是___________,证据是___________。
(3)任写一个步骤Ⅲ中发生反应的化学方程式___________。
(4)步骤Ⅲ所得浅绿色滤液中一定含有的溶质是___________。
化学使世界变得绚丽多彩.如图是物质之间发生化学反应的颜色变化.
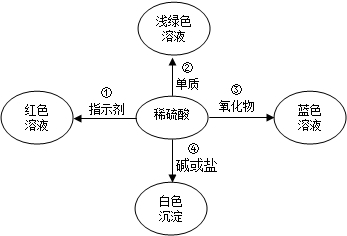
(1)请你在编号②、③处各填入一种物质.②是;③是;
(2)根据上图可以总结出稀硫酸的五个化学性质.请你写出编号①稀硫酸的化学性质.
(3)若编号④的物质是盐.请你写出符合编号④的一个化学方程式:,反应类型是.
海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如下图: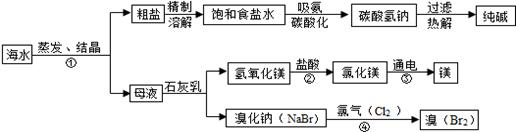
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是 。
(3)由上述流程图看出碳酸氢钠的热稳定性 (填“大于、小于或等于)纯碱的热稳定性。
(4)步骤②发生的反应属于 反应(填一种基本反应类型)。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),
反应后溴元素的化合价比反应前 (填“升高”或“降低”或“不变”)。
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 |
第 1 次 |
第 2次 |
第 3次 |
| 所取固体样品的质量/g |
13 |
10 |
10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g |
100 |
100 |
125 |
| 反应后生成沉淀的质量/g |
8 |
8 |
8 |
完成下列计算:
①固体样品中氯化钠的质量分数是 ;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
水是重要的资源。
(1)活性炭常用于净水,其作用是 。
(2)海水晒盐得粗盐,粗盐提纯的实验步骤为:溶解、 、蒸发结晶。
(3)水是一种重要的溶剂,(如图1)是硝酸钾和氯化钠的溶解度曲线。
①图中A点表示的含义是 。
②20℃,向50g水中加入25g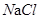 ,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
(4)水在化学实验中具有重要作用,将光亮的铁丝固定在U型管左端的塞子上(如图2),几天后,观察到的实验现象为 ;从实验中可以得出铁生锈的条件是 。
如图所示,若将稀硫酸比作初三学生,要求在“应急演练”中按照“距离最短”的原则从楼顶入口处由上至下疏散到出口处,已知各层都有三道门(空白处为通道),稀硫酸要在每层中各打开一道门(即能与稀硫酸反应的物质)后才能到达出口处。请分别写出疏散路线上依次发生反应的化学方程式,并按要求填空。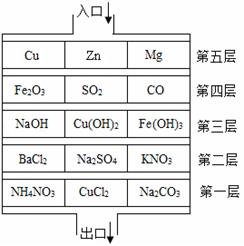
(1)第五层: ,该反应的基本反应类型是 ;
(2)第四层: ,反应前后溶液的颜色变化为 ;
(3)第三层: ,该反应属于 (选填“吸热”或“放热”)反应;
(4)第二层: ;
(5)第一层: ,该反应的基本反应类型是 。
(6)若将稀硫酸改为稀盐酸,则在疏散路线上无法通过第 层。
2012年3月22日是第二十届“世界水日”。水与人类的生活和生产密切相关。
(1)下列做法有助于保护水资源的是 。
A.禁止向河流中排放废水
B.禁止向乱扔垃圾
C.节约用水
(2)水的硬度过大会影响生产和生活,区分软水和硬水常用的物质是 。生活中可以通过________的方法来降低水的硬度。
(3)自来水厂净水过程为:天然水→加絮凝剂→沉降→过滤→吸附→加消毒剂→自来水。通常使用的絮凝剂是 ;X是一种新型的自来水消毒剂,制取X的化学方程式为:C12+2NaClO2=2NaCl+2X,则X的化学式为 。
(4)下图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。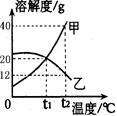
①溶解度随温度升高而增大的物质是 (填“甲”或“乙”);t1℃时,甲的溶解度_______乙的溶解度(填“大于”或“小于”或“等于”)。
②某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。
在溶液A、B、C中,属于饱和溶液的是___________;与溶液C质量相等的是______。
在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为______。
6分)下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
用上图表示的序号表示配制溶液的正确顺序_____ ____。
图②中,有一种塑料仪器,其名称是___ ______。
称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见右图,则称取的NaCl质量为 。
根据计算需要量取水的体积是 (水的密度为1g/mL)。量取读数时,右图视线角度正确的是_______。(选填字母标号)
称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%。
下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: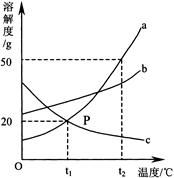
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,形成的是 (填“饱和”或“不饱和”)溶液,所得溶液质量为 g。
(3)a中混有少量的b,若要从混合液中分离出a可采用的方法是 。
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应。
(1)配制100g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 盘,称量其质量。然后按需要添加砝码、移动游码,再将氢氧化钠固体加入烧杯中,直至天平平衡。该步骤中用烧杯而不用纸称量氢氧化钠的原因是 。
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
【实验方案】
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且最终小至小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
①用pH试纸测定NaOH溶液pH时,正确的操作是: 。
②简述强调“测得的pH小于7”的理由: 。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该组同学根据 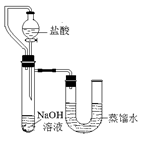
为维护食品安全,卫生部公告自2011年5月1日起,禁止在面粉生产中添加增白剂及过氧化钙等.
(1)过氧化钙的化学式为CaO2,其中氧元素与钙元素的质量比为 。
(2)正确看待和安全使用食品添加剂非常重要.下图是超市售卖的2种不同品牌橙汁的标签。

①2种橙汁均属于 (填“纯净物”和“混合物”).
②你更倾向于选择的品牌是: (填“A”或“B”)为防范添加剂危害,选购包装食品时应 (至少一条)。
(5)(3分)过氧化钙在养鱼时可用作增氧剂,多少克过氧化钙(CaO2)和49克氯酸钾(KClO3)中含氧元素的质量相等?(写出计算过程)
根据下图回答问题:
(1)若选用A装置用高锰酸钾制取氧气,还需补充的一种仪器是 (填名称),反应的化学方程式为: ;
(2)实验室若选用B装置制取二氧化碳,则需要改正的一点是 ,
请你写出用石灰石与稀盐酸反应制取二氧化碳的化学方程式 ;
(3)用制取的二氧化碳进行如下实验:
(I)向蒸馏水中滴入紫色石蕊溶液
(Ⅱ)向其中一支试管中通入二氧化碳
(Ⅲ)将通入二氧化碳的试管加热
①实验(II)中溶液变为 色;
②实验(III)中加热之后,溶液又变为 色,解释出现此现象的原因 (用化学方程式表示)。
(4)同学们在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质)。为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示。
请计算:
①当废液中盐酸完全反应时,生成的二氧化碳的质量为多少?
②当废液中两种物质刚好消耗完毕时,所得溶液中溶质的质量分数为多少?(计算结果精确到0.1%)
废旧金属可以回收利用,用合金废料(含
)制取
和
溶液的实验流程如图(部分生成物已略):

(1)合金属于(填"纯净物"或"混合物");
(2)步骤①反应的化学方程式为:
↑,依据质量守恒定律推出
的化学式为,步骤②反应的化学方程式为;
(3)由
制取
溶液有以下三种途径:
I.
↑
Ⅱ.
O
Ⅲ.
↑
你认为最佳途径是(填序号),理由是.