铜制器物在潮湿环境中表面会产生绿色的锈迹,俗称铜绿。某化学学习小组对铜绿成分产生了浓厚兴趣。
【提出问题】铜绿中除铜元素外还有其它什么元素?
【查阅资料】①无水硫酸铜遇水变蓝色;
②碳与一般的酸不反应;
③CuO+H2SO4(稀)=CuSO4+H2O。
【实验探究】该小组同学找到了一些铜绿粉末并进行了如下实验:
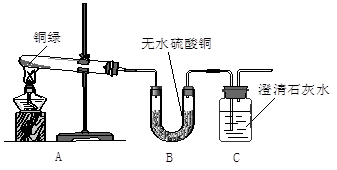
【观察分析】A装置中绿色粉末变为黑色;
B装置中无水硫酸铜变为蓝色;
C装置中澄清石灰水变浑浊,该反应的化学方程式为 。
【实验结论】铜绿中除铜元素外还有 、 和碳等元素。
【交流讨论】根据铜绿的组成,小组同学对A装置中产生的黑色粉末的成分有如下两种不同的猜想:
(1)全部为CuO (2)CuO和C的混合物
【深入探究】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
① |
猜想(1)正确 |
| ②①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
② |
猜想(2)正确 |
【实验结论】化学学习小组同学通过实验证明猜想(1)正确。
【反思应用】根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的 等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与 接触。
化学使世界变得绚丽多彩.如图是物质之间发生化学反应的颜色变化.
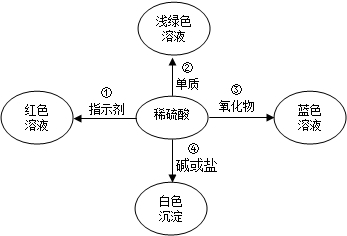
(1)请你在编号②、③处各填入一种物质.②是;③是;
(2)根据上图可以总结出稀硫酸的五个化学性质.请你写出编号①稀硫酸的化学性质.
(3)若编号④的物质是盐.请你写出符合编号④的一个化学方程式:,反应类型是.
碘是人体必须的微量元素,海带因富含碘元素而成为补碘的常用食物之一.小李想设计实验验证海带中含有碘元素.他查阅了相关资料,得到以下信息:
①碘化钠(
)与氯化钠性质相似,两者的溶液都是盐溶液,碘化银为黄色难溶于水的固体.
②工业上将适量氯气通人无色碘化钠溶液就能置换出单质碘,溶液变为棕黄色.
③少量碘((
)溶于水的溶液,能使淀粉溶液变蓝,碘的化合物不能使淀粉溶液变蓝.
④灼烧海带后残留的灰烬中含有可溶性碘化钠、氯化钠等化合物.
小李的实验步骤如下:
将海带灰用蒸馏水充分浸泡后过滤,得滤液;然后用以下3种方法,去检验海带灰中是否含有碘元素.
方法一:取滤液,通入适量氯气后与淀粉糊混合,观察是否变蓝.
方法二:取滤液,通入适量的氯气,观察溶液有无颜色变化.
方法三:取滤液,和淀粉糊混合,观察是否变蓝.
请回答下列问题:
(1)氯气和碘化钠反应的化学方程式:.
(2)上述3种方法中,方法是一定不可行的,说出不可行的理由:。
(3)取滤液,滴人硝酸银溶液,若观察到,则证明滤液中含碘离子.
下列物质由H、C、O、Fe四种元素中的一种或几种组成,它们是初中化学常见的物质。
(1)若某单质为最清洁的燃料,它的化学式是 。
(2)若某化合物能燃烧,则化合物中一定含有的元素是 。
(3)甲、乙、丙三种物质在一定条件下存在如下转化关系(图中已略去部分物质)。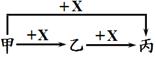
①若只有甲为固体,其他物质均为气体,则X是 ,乙→丙反应的化学方程式是 。
②若甲、乙、丙均为固体,且甲为红色,乙和丙为黑色,在甲与X 生成乙的反应中甲与X的质量比为120︰7。甲→丙反应的化学方程式是 ,甲→乙反应的化学方程式是 。
铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示: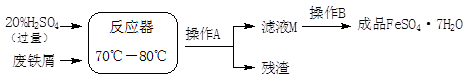
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
下列是初中化学部分重要的实验或实验装置。请按要求填空: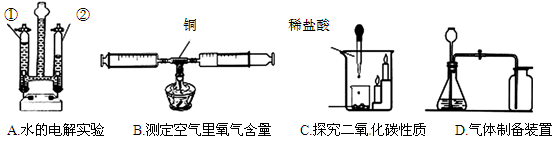
(1)A实验玻璃管②中产生的气体是 ;
(2)B实验如果实验数据小于21%,可能原因是 、 (写出两点);
(3)C实验说明二氧化碳具有的性质是 、 ;
(4)写出用D装置制取二氧化碳气体的化学方程式 。
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液之间能否发生反应,将表中内容补充完整.
| 氢氧化钠溶液 |
氯化钠溶液 |
碳酸钾溶液 |
硝酸钡溶液 |
|
| 稀硫酸 |
能反应 |
不能反应 |
能反应 |
|
| 判断依据 |
有水生成 |
没有水、气体、沉淀生成 |
【提出问题】稀硫酸与氢氧化钠溶液的反应没有观察到明显现象,是否真的发生了反应?
【实验方案】小丽同学设计实验方案进行探究,证明氢氧化钠溶液与稀硫酸发生了反应,请你和她一起完成实验报告.
| 实验操作 |
实验现象 |
| ①向试管中加入约2稀氢氧化钠溶液,滴加2滴溶液 |
|
| ②向①所得液体中滴加过量稀硫酸 |
【实验结论】稀硫酸与氢氧化钠溶液发生了反应;
【实验拓展】小丽结合所学知识,认为初中常见的酸碱之间一定能发生复分解反应,她判断的依据是.
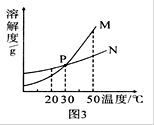
20℃时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题: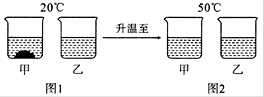
(1)图1中一定为饱和溶液的是 _______。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为________________。
(3)图3中表示乙的溶解度曲线是________;
化学支撑科技,化学改变生活。请结合所学知识回答:
(1)“材料创新”标志着人类文明的进步。
①“神舟十号”飞船的发射让航天员再次访问“天宫一号”。资源舱舱段使用了铝锂合金材料代替传统材料,铝锂合金属于________材料(“金属”“合成”或“复合”)。
②据《苍梧晚报》报道:国内首把碳纤维小提琴由某集团碳纤维应用研究中心研发制造,其中碳纤维属于________材料(填“金属”或“合成”或“复合”)。
(2)“科学膳食”是人类健康的保障。
小明的食谱中缺少富含维生素的食物,你建议他增加________(填一种);当他剧烈运动大量出汗后,你建议他饮用含________的运动饮料(填六大营养素之一)。
(3)“安全意识”在我们心中共鸣。
①天然气或沼气(主要成分均为CH4,其密度小于空气)已在城乡普遍入户,万一燃气泄漏,应采取的措施是______________,为了及时发现漏气,可在厨房墙壁的________方安装报警器(填“上”或“下”)。
②稀释浓硫酸时,为了防止酸液溅出造成伤害,操作时一定要注意________(填“水入酸”或“酸入水”),并缓慢注入,且用玻璃棒不断________(填操作名称)。
下面四个观点都是错误的。写出你熟悉的化学反应方程式,否定相应的各错误观点:
| 序号 |
错误观点 |
否定例证(用化学方程式表示) |
| (1) |
分解反应一定有单质生成 |
|
| (2) |
凡有化合物生成的反应都是化合反应 |
|
| (3) |
有单质和化合物生成的反应一定是置换反应 |
|
| (4) |
有盐和水生成的反应一定是中和反应 |
|
理解、掌握质量守恒定律是学好化学的基础。
(1)某同学按右图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,请你用质量守恒定律解释其原因是 ;发生反应的化学方程式是 。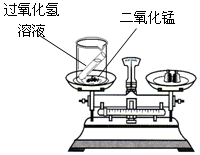
(2)由质量守恒定律可知,在化学反应前后,一定不变的
是 (填序号)。
①分子种类②原子种类③分子数目④原子数目⑤物质质量⑥元素种类
(3)4.14玉树地震给当地人民造成巨大损失。为防止灾后发生疫情,必须对灾区进行消毒,其中的一种消毒剂是漂白粉,它的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙能与水和二氧化碳发生反应,请完成这个反应的化学方程式:
Ca(ClO)2 +CO2 + H2O=CaCO3↓+2 。
(4)A、B、C三种物质各15 g,它们化合时只生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只剩余B。根据上述条件推断下列说法中正确的是 (填字母)。
A.该反应中,B是催化剂
B.第一次反应停止后,C剩余9 g
C.第二次反应后,D的质量为50 g
D.反应中A和B的质量比是5∶2
E.反应中A和C的质量比是5∶2
水是重要的物质,在实验室中常用于溶解物质、配制溶液。
(1)向50mL水(密度为1g/mL)中溶解一定量的KNO3固体的操作如下,请根据下图实验现象和溶解度曲线回答。
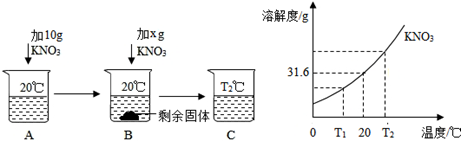
A、B、C中一定是饱和溶液的是 ,一定是不饱和溶液的是 ;(填字母)
‚当χ= g时,B中恰好没有固体剩余;ƒ硝酸钾林溶液中析出晶体常用 方法。
(2)根据下列仪器,欲配制一定质量分数的食盐溶液,回答下列问题。
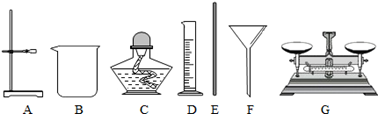
上面的仪器中除D、E外,还必须选用的仪器有 ;(填字母)
‚E的作用是 ,配制的步骤可以概括为计算、称取和量取、 、装瓶贴标签。
FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
【阅读资料:】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀的pH |
1.9 |
4.7 |
| 沉淀完全的pH |
3.2 |
6.7 |
(1)进行操作x时,应用到的仪器有:铁架台、玻璃棒、烧杯和 。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少 (填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理。
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。

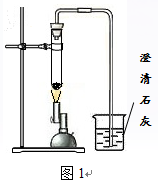
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下:
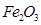 为红色固体;
为红色固体;  和
和 均为黑色固体。其中,
均为黑色固体。其中, 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3H₂O
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验 ;
; 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:① ②
② ③
③ ④ ⑤
④ ⑤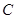
【实施实验】
目的:确定固体X的组成。
| 步骤 |
操作 |
主要现象 |
结论 |
| I |
取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 |
部分固体被吸引到磁铁上 |
可能有 或 或 |
| II |
取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 |
固体剧烈燃烧, b中溶液变浑浊 |
一定有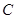 |
| III |
另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 |
无明显现象 |
一定没有 |
| IV |
取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 |
产生 。 |
一定有 |
| V |
在步骤IV所得溶液中逐滴加入 。 |
溶液不变红色 |
一定没有 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有 ,理由是 。
,理由是 。
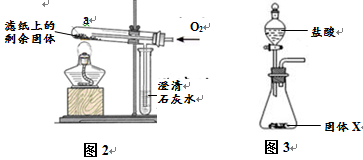
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 |
操作 |
数据 |
| I |
重新取部分冷却至室温的固体X,称量其质量为m1。 |
m1 =" 17.9" g |
| II |
将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3。 |
m2 =" 317.9" g m3 = 317.3.g |
| III |
将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 |
m4 =" 1.1" g |
【获得结论】
(1)为确定固体X中是否含 ,m1~m4中应该用到的数据有 。
,m1~m4中应该用到的数据有 。
(2)固体X的成分及质量分别是 。
铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
【提出假设】对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如下:
| 金属 |
Cr |
Al |
Cu |
| 与盐酸反应的现象 |
气泡产生缓慢,金属逐渐溶解 |
气泡产生剧烈,金属迅速溶解 |
无气泡产生,金属无变化 |
【控制实验条件】打磨三种金属的目的是 ;
【得出结论】原假设中正确的是 (填假设中a、b或c)。写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式 。
【结论应用】根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤.向滤出的固体中加入盐酸,无明显现象,则滤液中一定有的物质是 。