[北京]2010届北京市房山区中考二模化学试卷
五氧化二碘(化学式为I2O5)常用来测定空气中一氧化碳的含量,I2O5中碘元素化合价为
| A.-5 | B.+3 | C.+5 | D.+2 |
下列有关氧气的“自述”,错误的是
| A.我不易溶于水 | B.我具有可燃性 |
| C.我能供给呼吸 | D.我的化学性质比较活泼 |
我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球轨道,该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2 NH4ClO4 N2↑+Cl2↑+4H2O ↑+2O2↑,请判断该反应的基本反应类型是
N2↑+Cl2↑+4H2O ↑+2O2↑,请判断该反应的基本反应类型是
| A.分解反应 | B.化合反应 | C.置换反应 | D.复分解反应 |
下列反应的化学方程式中,书写正确的是
| A.氢气在空气中燃烧2H2 +O2 ="=" 2H2O |
| B.铁丝在氧气中燃烧4Fe + 3O2 ="====" 2Fe2O3 |
C.实验室制取氧气2KMnO4  K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| D.氢氧化钠与硫酸发生中和反应2NaOH+H2SO4==NaSO4 +2H2O |
下列对分子、原子、离子的认识正确的是
| A.原子是最小的粒子,不能再分 |
| B.分子是化学变化中不可再分的粒子 |
| C.离子是原子中质子数发生变化形成的粒子 |
| D.原子的最外层电子数与元素的化学性质密切相关 |
区别下列各组物质,选用的方法或试剂中,不正确的是
| A.水和酒精——闻气味 |
| B.棉布料和化纤布料——灼烧、闻气味 |
| C.空气、氧气和二氧化碳——燃着的木条 |
| D.氢氧化钙、盐酸、氢氧化钠三种溶液——无色酚酞溶液 |
下列物质的用途,正确利用了其化学性质的是
①甲烷用作燃料②食盐用作调味品③干冰用作制冷剂
④氧气用于气焊 ⑤熟石灰用于改良碱性土壤
| A.只有①④ | B.只有①④⑤ | C.只有②④⑤ | D.只有①③⑤ |
下表列出了除去物质中所含少量杂质的方法,其中错误的是
| |
物质 |
所含杂质 |
除去杂质的方法 |
| A |
O2 |
CO2 |
通过足量的氢氧化钠溶液,干燥 |
| B |
NaCl粉末 |
CaCO3粉末 |
溶解、过滤、蒸发 |
| C |
NaOH溶液 |
Na2CO3 |
加入足量稀盐酸至不再产生气泡 |
| D |
FeSO4溶液 |
CuSO4 |
加入过量的铁粉,过滤 |
向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些铁粉,充分反应后过滤。
下列说法正确的是
| A.滤纸上一定有Ag和Cu |
| B.滤纸上一定有Ag,可能有Cu、Fe和Mg |
| C.滤液中可能含有Fe2+、Mg2+ |
| D.滤液中一定有Fe2+、Mg2+,可能含有Ag+、Cu2+ |
某化学兴趣小组设计了如图所示的实验装置,用于“测定空气中氧气的含量”(试管的容积为50 mL,注射器的活塞实验前停在25 mL处。容器内红磷足量)。用酒精灯加热装置中的红磷,充分反应直至燃烧结束,试管冷却,可观察到装置中活塞最终停留的接近刻度是
| A.20 mL处 | B.15 mL处 | C.10 mL处 | D.5 mL处 |
医用葡萄糖(C6H12O6)注射液是由葡萄糖、水配制而成的。测得某葡萄糖注射液中碳元素的质量分数为20%,则该注射液中溶质的质量分数为
| A.50% | B.40% | C.30% | D.20% |
在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要使其他因素保持不变,以探究此种因素对实验结果的影响。下表是稀硫酸与某金属反应的实验数据:
通过分析上述数据得出的结论不正确的是:
| A.对比实验1和2、4和5,可得出固体反应物的表面积越大,反应越快的结论。 |
| B.表明反应物的溶质质量分数越大,反应越快的只有2和5 |
| C.表明反应体系的温度越高,反应越快的只有6和7。 |
| D.实验中的所有反应,反应前后溶液的温度变化值相近(约15℃),推测其原因是:所有反应中,金属质量和硫酸体积均相等,且金属完全反应,产生热量相等,所以溶液温度变化值相近。 |
随着生活水平的提高,人们越来越关注自身的健康。请你参与下列关于化学物质与人体健康问题的讨论。
⑴能调节新陈代谢,但一般在人体内不能合成,可从水果、蔬菜中摄取的营养素是 (填序号)
| A.蛋白质 | B.糖类 | C.油脂 | D.维生素 |
(2) 蛋白质是构成细胞的基本物质,维持人体的生长发育和组织更新。糖类是人体所需能量的主要来源,在人类食物所供给的总能量中有60% ~70% 来自糖类。下表是某食品包装上的说明。从配料中分别选出一种物质,填在相应的横线上。富含蛋白质的是 ,富含糖类的是 。
| 品名 |
X X X |
| 配料 |
鲜鸡蛋、面粉、白砂糖、精炼植物油、奶油、食盐、柠檬汁 |
| 生产日期:标于包装袋上 |
(3)人体摄入过多食物时,会引起过多胃酸分泌,胃液的pH下降,使人体感到不适,此时服用抗酸剂能有效调节胃内的pH。双羟基铝碳酸钠就是一种常用抗酸剂,其化学式为NaAl(OH)2CO3,它是由 种元素组成,其中铝元素与氧元素的质量比为 。
水是生命之源,万物之基,是人类最宝贵的自然资源。
(1)淡水资源不足,将严重影响人类的生存。请结合下表回答:
①我国也是缺水国家之一,北京人均水量不足300 m3·a-1,是 缺水城市。
②为保障生活用水的卫生,常采用净化水的方法有吸附、沉淀、 和蒸馏等方法,其中吸附方法中常用作除去臭味的物质是 。
(2)化学课上,同学们用如右图所示装置探究水的组成。
①通电一段时间后,在试管1和试管2中分别收集
到 (填名称),有关反应的化学方程式为_______。
②下图是水分子在一定条件下分解的示意图,从中
获得的信息正确的是 。
| A.水分解后生成氢气和氧气的分子个数比为2:1 |
| B.在化学变化中分子是最小的粒子 |
| C.一个水分子由一个氢分子和一个氧原子构成 |
| D.化学反应的实质是分子分解成原子,原子重新组合生成新的分子的过程 |
(7分)溶液在生产和生活中具有广泛的用途。
(1)生理盐水是0.9%的氯化钠溶液,医疗上常用其给病人补充体液。
①生理盐水中的溶质是 (写化学式)。
②现需100g生理盐水,若按如下操作配制,正确的顺序是(填字母) 。
A B C D E
此生理盐水若用10%的溶液加水稀释而得到,则需10%的溶液 g。
(2)在20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10 g水,使其充分溶解,观察到如右图1所示的现象。
①20℃时, (填“甲”或“乙”)的溶液一定是饱和溶液。
②右图2中表示甲、乙物质的溶解度曲线的分别是b和a,将20℃乙物质的饱和溶液降温到10℃,其溶质质量分数 (填“变大”、“变小”或“不变”)。
(3)部分酸、碱、盐在水中可解离出阴阳离子,复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀。如下图是氢氧化钠溶液和盐酸反应实质的微观示意图。
请你依据部分碱盐溶解性表和复分解反应实质判断下列两组物质(①硫酸钠和氢氧化钡、②硫酸钠和氯化亚铁)在水中混合后能否发生反应,若能,仿照上述的示例在下图的圆圈中填入适当的物质或离子符号,来体现反应的实质。
理解、掌握质量守恒定律是学好化学的基础。
(1)某同学按右图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,请你用质量守恒定律解释其原因是 ;发生反应的化学方程式是 。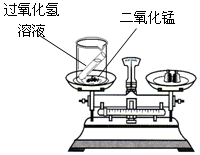
(2)由质量守恒定律可知,在化学反应前后,一定不变的
是 (填序号)。
①分子种类②原子种类③分子数目④原子数目⑤物质质量⑥元素种类
(3)4.14玉树地震给当地人民造成巨大损失。为防止灾后发生疫情,必须对灾区进行消毒,其中的一种消毒剂是漂白粉,它的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙能与水和二氧化碳发生反应,请完成这个反应的化学方程式:
Ca(ClO)2 +CO2 + H2O=CaCO3↓+2 。
(4)A、B、C三种物质各15 g,它们化合时只生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只剩余B。根据上述条件推断下列说法中正确的是 (填字母)。
A.该反应中,B是催化剂
B.第一次反应停止后,C剩余9 g
C.第二次反应后,D的质量为50 g
D.反应中A和B的质量比是5∶2
E.反应中A和C的质量比是5∶2
已知A、B、C、D、E为初中化学常见物质,“—”表示两端的物质能相互反应,“→”表示物质间的转化关系。请回答下列问题。
(1)如右图所示,若A、B为氧化物, D、E为单质,C为能供给呼吸的气体,D转化为E的反应有浅绿色液体生成。则:C的化学式为 ,A与B反应的化学方程式
为 ,E可能是 (填一种即可,写化学式)。
(2)如右图所示,若A、B、C、D、E均为化合物,D中各元素的质量比为10:3:12, A、B、C中均含三种元素。则:D的化学式为 ,D与E反应的化学方程式为 ,A转化为B的化学方程式为 。
(8分)化学实验是学习化学的基础,请根据下列装置图回答问题。



A B C
(1) A实验:把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳具有 、 和 的性质,因此二氧化碳在实际生活中可用于灭火。
(2) B实验:有关反应的化学方程式为 ;烧杯中热水的作用是使白磷与空气隔绝和 ;通过该实验可得出燃烧需要三个条件:①可燃物②可燃物与 接触③温度达到 的结论。
(3) C实验:试管③实验的目的是探究铁钉在 的情况下是否生锈;试管①中的铁钉与水面接触的一圈最容易生锈,其原因是___________。
为了研究炼铁原理,在老师的指导下,同学们在实验室的通风橱内利用下图所示装置(其它实验用品略),进行一氧化碳与氧化铁反应的实验,请你一起参与(每套装置限用一次,可以不用)。
A B C
(1)实验室制得的一氧化碳中常混有二氧化碳和水蒸气,欲用纯净、干燥的一氧化碳还原氧化铁并检验生成的气体,正确连接装置导管口的顺序是:混合气体→ →g→尾气处理(填导管接口代号)。
(2)装置B中反应的化学方程式 。
(3) C实验中玻璃管内观察到的现象为 ;有关反应的化学方程式为 ;
(4)本实验停止加热前没有将装置C与D的连接处断开,停止加热后未观察到溶液倒吸现象,请你分析可能的原因是 。
右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
【查阅资料】
(1)酒石酸是一种易溶解于水的固体有机酸
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO3受热不分解。
【提出问题】
NaHCO3在发酵粉加水或加热时如何产生CO2?
【猜 想】
甲:……
乙:酒石酸与NaHCO3在溶液中反应产生CO2
丙:NaHCO3加热产生CO2
【实验探究】
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是 ;小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是
。
(2)小英同学为探究猜想丙设计了右图所示的实验装置:
小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有无色液滴生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为 。持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有气泡冒出,则该粉末是 。
【解释与结论】
NaHCO3在发酵粉中产生CO2的条件是 ;
NaHCO3受热发生变化的化学方程式为 。
综合实践活动小组在调查当地农业生产化肥的使用情况时,某厂生产的尿素引起了他们的兴趣,右图是他们看到化肥袋上的标识说明。请阅读标识后回答:
(1)尿素属于化肥中的 (填氮、磷或钾)肥。
(2) CO(NH2)2中氮元素的质量分数。
(3) 根据标识说明计算,每袋尿素中有效营养元素的含量不低于 千克。






 粤公网安备 44130202000953号
粤公网安备 44130202000953号