某化学兴趣小组做粗盐提纯实验,并对粗盐的成分作进一步探究。请回答下列问题:
实验一:粗盐提纯
(1)提纯实验多次用到了玻璃棒,请写出该实验中使用玻璃棒的一个作用① ;
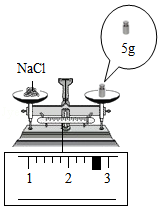
(2)蒸发后所得食盐质量② (读数见图)。
实验二:物质检验
[提出问题]食盐中除含有NaCl外,可能还含有什么溶质?
查阅资料一]食盐中可能还含有Na2CO3、Na2SO4等。
[作出猜想]猜想一:含有溶质Na2CO3;
猜想二:含有溶质Na2SO4;
猜想三:③ 。
[查阅资料二]Na2CO3溶液、Na2SO4溶液均可以与BaCl2溶液反应生成白色沉淀,且BaCO3可以溶于盐酸,BaSO4不能溶于盐酸。
[讨论交流]小组同学经讨论后认为:选择BaCl2溶液和稀盐酸两种试剂即可验证猜想。若猜想二正确,则发生反应的化学方程式为④ 。
[实验验证]为验证猜想,小组同学设计了如下实验方案。
Ⅰ.取上述食盐样品少量于试管中,加水溶解,得到澄清透明溶液;
Ⅱ.向溶液中滴加过量的BaCl2溶液,生成白色沉淀,静置;
Ⅲ.静置后弃去清液,加入足量稀盐酸,发现沉淀部分溶解,且有气泡产生。
[实验结论]根据上述实验现象判断⑤ 是正确的(填“猜想一”、“猜想二”或“猜想三”)。
[问题与交流]小组同学在实验报告中记录了如下文字:经实验验证,该食盐样品中仅含有NaCl、Na2CO3和Na2SO4,你认为这个观点⑥ (填“正确”或“错误”)。请说明你选择的理由⑦ 。
在实验室中,我们常用如图所示装置制取和收集某些气体。

(1)写出a、b两种仪器的名称。a ,b为 。
(2)实验室若用KMnO 4制取O 2,写出其化学方程式 ,相应的发生装置为 (填字母代号)。
(3)若选用装置C制备CO 2,则可以选择 (填字母代号)。
a.块状碳酸钙和稀盐酸
b.块状碳酸钙和稀硫酸
(4)经查阅资料,Na 2O 2(过氧化钠)也能与水迅速反应产生O 2.补全下列反应方程式:2Na 2O 2+2H 2O═
(5)收集O 2适合选用 装置(填字母代号)。
a.仅D
b.仅E
c.D和E
覆铜板是制作印刷线路板的基本材料。覆铜板中的金属Sn占2﹣10%,Cu占90﹣98%.简易工艺流程如图:
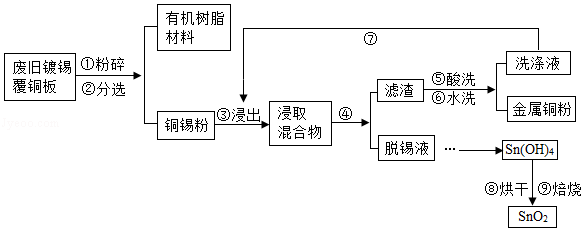
(1)将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是 的性质(填字母代号)。
a.溶解性不同
b.密度不同
c.沸点不同
(2)步骤④中涉及的分离操作是 (填操作名称)。
(3)通过步骤⑤和⑥所得洗涤液的pH 7(填“>”、“<”、“=”)。
(4)设计步骤⑦的主要目的是 。
(5)步骤⑨中涉及的主要化学方程式为 。
读取图片信息后回答:
(1)此消毒液的有效成分是什么? 。有效成分的含量为多少? 。
(2)结合化学常识,谈谈你对标签中"密闭,避光保存"和"易燃,应远离火源"的理解 。

为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如下实验:向盛有10g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为90g,反应后烧杯内物质的总质量为95.6g。(杂质不溶于水也不与酸发生反应)
已知反应的化学方程式如下:2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O
(1)该反应生成二氧化碳的质量为 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
在学习复分解反应发生的条件后,同学们利用已学知识,对稀硫酸与下表中的四种化合物的溶液之间能否发生反应作出判断,并进行实验验证:
物质 |
NaOH溶液 |
NaCl溶液 |
K2CO3溶液 |
Ba(NO3)2溶液 |
能否反应 |
能 |
不能 |
能 |
能 |
实验现象 |
无明显现象 |
无明显现象 |
产生气泡 |
产生白色沉淀 |
(1)判断NaOH溶液与稀硫酸能发生反应的依据是生成物中有 生成。
[提出问题]对于没有明显现象的反应,如何设计实验进行证明?
[设计实验]在老师的指导下,同学们向少量稀硫酸中逐滴加入过量NaOH溶液,并进行了如下分组实验:
组号 |
操作 |
实验现象 |
结论 |
1 |
用pH试纸测定实验前后溶液的pH |
pH由1变至9 |
能反应 |
2 |
向反应后的溶液中加入适量Ba(NO3)2溶液 |
溶液产生白色沉淀 |
不能反应 |
3 |
向反应后的溶液中加入适量K2CO3溶液 |
能反应 |
(2)若开始时将pH试纸用蒸馏水润湿。则测得的稀硫酸的pH将 (填“偏大”、“偏小”或“不变”)。
(3)请你判断第2小组同学得出的结论是否正确,并说明理由 。
(4)第3小组的实验现象为 。
[实验结论]对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多个角度设计实验进行证明。
[实验反思]向NaOH溶液中通入少量CO2.再向其中加入 ,有气泡产生,即可证明NaOH与CO2发生了反应。
[拓展提升]稀硫酸与NaCl溶液不能发生反应,请你设计实验进行证明 (写出实验操作与现象)。
实验室里现有氯酸钾,二氧化锰、过氧化氢溶液,以及下列仪器:
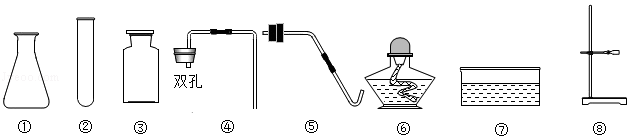
(1)请写出标号⑦的仪器名称 。
(2)利用上述仪器和药品可以制取O2,你选择的药品是 ,不需要选择的仪器是 (填序号)。
已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请分析后回答:
(1)D的化学式 。
(2)B与G反应的化学方程式 。

化学在保证人类生存并不断提高生活质量方面起着重要的作用,利用化学综合应用自然资源,以使人类生活得更加美好。目前,人们使用的燃料大多来自化石燃料,如煤、石油、天然气等。煤的综合利用如图所示:

已知高炉内发生的主要化学反应如下:
C+O2 CO2
C+CO2 2CO
3CO+Fe2O3 2Fe+3CO2
(1)将煤隔绝空气加强热的过程是 变化。
(2)粗氨水经提纯后可用作化肥,是因为含有植物所需的 (填元素符号)。
(3)焦炭常作为炼铁工业的原料,请你分析焦炭在炼铁过程中的作用 。
我国著名的化学家侯德榜发明了联合制碱法,大大提高了原料的利用率,其反应原理之一为NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,某化工厂消耗117t氯化钠,理论上可生产碳酸氢钠的质量是多少?
(注:在20℃时,将二氧化碳通入含NH3的饱和NaCl溶液中能生成 NaHCO3晶体和NH4Cl溶液)
被称为“活化石”的银杏树在我市随处可见,银杏果中富含的银杏酸(化学式为C22H34O3)具有较高的药用价值。请你计算:
(1)银杏酸的相对分子质量 ;
(2)银杏酸中碳元素与氧元素的质量比 。
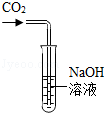
某化学兴趣小组在探究氢氧化钠的化学性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究。
探究一:二氧化碳是否与氢氧化钠溶液发生了化学反应?
取少量大试管中的液体,滴加足量的稀盐酸,观察到 ,证明二氧化碳与氢氧化钠发生了反应。
探究二:反应后大试管中溶液所含溶质的成分是什么?
[查阅资料]
1、CO2与碳酸钠溶液反应:Na2CO3+CO2+H2O═2NaHCO3
2、NaHCO3溶液呈碱性,能与NaOH反应,且与澄清石灰水反应生成白色沉淀
3、BaC12溶液呈中性,与Na2CO3反应生成白色沉淀,与NaHCO3不发生反应
小组成员经过分析讨论,一致认为溶质的成分为Na2CO3、NaHCO3、NaOH中的一种成几种。
[猜想假设]
猜想一:NaOH、Na2CO3
猜想二:Na2CO3
猜想三:
猜想四:NaHCO3
[实验探究]
序号 |
实验操作 |
实验现象 |
① |
取一定量大试管中的溶液于试管中,加入足量的BaCl2溶液 |
产生白色沉 |
② |
过滤 |
/ |
③ |
取一定量的滤液于试管中,加入澄清石灰水 |
没有明显现象 |
④ |
取一定量的滤液于另一支试管中,滴加适量酚酞溶液 |
|
[实验结论]
根据观察到的实验现象得出猜想 成立。
[实验反思]
化学反应是否发生,可以借助反应过程中伴随的实验现象来判断:也可以借生成物的性质来判断。
利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):
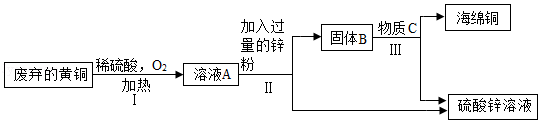
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
如图是实验室制取气体的部分装置,回答有关问题。

(1)指出图中标示的仪器名称:a 。
(2)实验室若选用B装置制备氧气,反应的化学方程式 。收集氧气可选择的装置 (填一个序号)。
(3)实验室制取二氧化碳时,常选用C装置收集气体,证明是否集满的方法是 。