某课外活动小组按右图所示装置制取二氧化碳,并检验二氧化碳的性质:若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是 ,当①、②导管口连接时,B中看到的实验现象是: ,
其反应的化学方程式为: 。
当导管断开一段时间后,看到B中的现象是 ,
其反应的化学方程式为: .
为测定当地石灰石含碳酸钙的质量分数,该课外活动小组取来一些矿石,并取稀盐酸200g,将其平均分成4份,进行实验,其结果如下:
| 实验 |
第1份 |
第2份 |
第3份 |
第4份 |
| 加入样品的质量/g |
5 |
10 |
15 |
20 |
| 生成CO2的质量/g |
1.54 |
3.08 |
4.4 |
m |
依据表中数据请分析计算:
(1)哪几项反应中盐酸有剩余 。
(2)上表中m的数值是 。
(3)试计算这种石灰石中碳酸钙的质量分数。
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程
中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
(3)请在右面坐标图中,画出煅烧时生成气体的质量(m)
随时间(t)变化的曲线.
某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。
| |
甲 |
乙 |
丙 |
丁 |
| 所取固体样品的质量/g |
25 |
25 |
20 |
20 |
| 加入硫酸溶液的质量/g |
50 |
100 |
100 |
120 |
| 反应剩余固体质量/g |
21 |
17 |
12 |
12 |
| 反应掉固体的质量/g |
4 |
8 |
|
8 |
请分析上述数据,解答下列问题:
(1)丙同学实验所用20g样品中有 g的 参加了反应;
(2)四位同学中, 两位同学所取的硫酸溶液质量不足(填写“甲”、“乙”、“丙”或“丁”);
(3)计算混合物氧化铜的质量分数;
(4)计算硫酸溶液中的溶质质量分数。
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20g,向其中逐滴加入质量分数为19.6%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用稀硫酸的质量关系如图所示。试计算:
(1)黄铜样品中铜的质量分数;
(2)反应中消耗的稀硫酸的质量;
(3)反应后所得溶液的质量。
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表: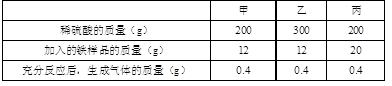
请你认真分析数据,回答下列问题:
⑴___________同学所取用的稀硫酸与铁样品恰好完全反应;
⑵计算样品中铁的质量分数;
⑶计算恰好完全反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物。向其中逐渐滴加溶质质量分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1) 当滴加稀盐酸至图中B点时,烧杯中溶液的
pH 7(填>、=、<)。
(2) 原混合物中碳酸钠的质量。
(3) 当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常
温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)。
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数。已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g, 从反应开始至以后的6分钟内,每1分钟读1次数并记录。结果如下:
| 时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
| 质量/g |
60.0 |
58.0 |
57.0 |
56.8 |
56.7 |
57.2 |
56.7 |
试回答下列问题:
(1)表中有一个测定结果误差较大,这点所在的时间是第_______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图;
(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程)。
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)求:
| |
实验1 |
实验2 |
实验3 |
实验4 |
| 加稀硫酸质量 |
150g |
240g |
330g |
400g |
| 剩余固体质量 |
12g |
7.2g |
4g |
4g |
(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应。
此时烧杯内各物质的总质量为64.9 g。试计算:
(1)原混合物中铁粉的质量分数。
(2)反应后所得溶液中溶质的质量分数。(保留一位小数)
工业上用电解NaCl溶液的方法来制取NaOH、Cl2和H2,反应的化学方
 |
程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑。现取一定质量分数的
NaCl溶液214.6g进行电解,当NaCl完全反应时,生成0.4gH2。
(1)当NaCl完全反应时,生成Cl2的质量为 g,参加反应的NaCl的质量为 g。
(2)当NaCl完全反应时,所得NaOH溶液中溶质的质量分数为多少?(假设生成的Cl2和H2全部逸出)
某同学打算用金属与稀硫酸反应制备氢气.
(已知:Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑)
铝、铁、锌的市场价格分别为:铝—4800元/t、铁—2100元/t、锌—10800元/t。如果不考虑其他因素,该同学要制备2g的氢气,选择哪一种金属最经济合算