构建知识网络是一种重要的学习方法。图为某校化学学习小组的小阳同学绘制的铁的化学性质网络示意图。请分析回答下列问题: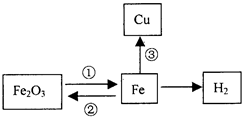
(1)反应①中可用 ▲ (填化学式)作还原剂;
⑵写出高炉中发生的反应①的化学方程
式: ▲ ;
写出反应③的化学方程式 ▲ ;
⑶反应②导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法。这两种方法的共同原理是阻止钢铁
与 ▲ 接触;
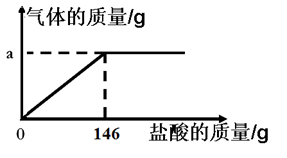
⑷该化学学习小组为了分析生铁中铁的含量,进行了如下实验研究:取12g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见右下图)。(说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应。)
①铁完全反应用去盐酸的质量为 ▲ g。
②生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
▲
(5)某同学列出了如下计算式:
生铁与盐酸刚好反应完全时所得溶液质量= (146+12-a)g
小明对该计算式提出了质疑,请指出其中的错误 ▲
。
(6)小华另设计了一个实验方案:用12g生铁粉与20%的硫酸铜溶液反应来分析生铁中铁的含量。请你画出加入硫酸铜溶液质量与固体质量变化关系的曲线。
小苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂。资料显示,固态小苏打50℃以上或在潮湿的空气中开始逐渐分解生成碳酸钠、二氧化碳和水,270℃时完全分解。
(1)小苏打、纯碱、烧碱都是化工生产常用试剂,水溶液均显碱性,从物质分类角度看不属于盐的是 ▲ (填写化学式),小苏打的保存应注意 ▲ 。
(2)小苏打(NaHCO3)和纯碱中含钠元素质量分数较大的是 ▲ (填写化学式)。
(3)某化学兴趣小组同学为了对在干燥空气中久置的小苏打样品进行分析,称取一份31.4 g混合均匀的样品,用酒精灯对其充分加热,收集到干燥的CO2气体3.3 g。通过计算判断该小苏打样品是否变质,如果变质计算该样品中NaHCO3质量分数是多少?
氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生如下反应:
CaH2+2H2O = Ca(OH) 2+2H2↑。若要制得2 g氢气,需CaH2的质量为多少?
有两种外观类似黄金的合金①Cu-Zn和②Cu-Ag,若实验室只提供一瓶稀硫酸和必要的仪器。
(1)你认为能测出合金 (填序号)中铜的质量分数;
(2)取上述(1)中合金粉末20g放入烧杯中,加入50g稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g。
求:①产生氢气的质量;②求出该合金中铜的质量分数。
环保部门对某工厂的废水进行抽样分析,结果表明废水中含少量硫酸。取一定量废水用质量分数为2%的氢氧化钠溶液中和(已知废水中的其它成分不与氢氧化钠反应),至pH = 7时,消耗氢氧化钠溶液的质量为40g,同时测得反应后溶液质量为138g。请计算该工厂排放的废水中硫酸的质量分数。
小丽同学在某化工厂参加社会实践,与技术员一起分析由Na2CO3和NaCl组成的样品中NaCl的质量分数。现取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如下图所示的曲线关系。(水的密度为1g/mL,计算结果精确到0.1%)
(1)当Na2CO3与稀盐酸恰好完全反应时,消耗7.3%的稀盐酸的质量是 g;
(2)样品中NaCl的质量分数是多少?
(3)计算Na2CO3与稀盐酸恰好完全反应时,所得溶液的溶质质量分数。
某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品16g,把80g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
| 实验序号 |
加入稀盐酸的质量/g |
剩余固体物质的质量/g |
| 第1次 |
20 |
11 |
| 第2次 |
20 |
6 |
| 第3次 |
20 |
3.2 |
| 第4次 |
20 |
m |
(1)第4次剩余固体物质的质量m= g
(2)石灰石样品中CaCO3的质量分数为 。
(3)计算稀盐酸的溶质质量分数。
市场上有一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK) ,在去年我国南方地区抗击暴风雪中融雪剂发挥了一定的作用。请回答:
(1)醋酸钾中C、H、O元素的质量比为 ;
(2)392g醋酸钾中含有____ _____g碳元素;
(3)醋酸钾中钾元素的质量分数为 (保留一位小数)
取盐酸与氯化钙的混合溶液11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示
(1)通过右图可知,当碳酸钠溶液质量加到 kg时,溶液恰好完全反应 (盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2) 溶液恰好完全反应时所得溶液中所含溶质氯化钠质量?
为测定某NaCl、Na2CO3固体混合物的组成,小明同学取16g该混合物放入烧杯中,分五次加入稀盐酸(每次加入稀盐酸的质量为25g),待反应完全后,得到下面的质量关系:
请分析以上数据后计算:
⑴原固体混合物中Na2CO3的质量。
⑵当加入稀盐酸至固体混合物恰好完全反应时,所得溶液的溶质质量分数。(计算结果精确到0.1)
请根据右图中A、B两种固体物质的溶解度曲线,回答下列问题。
(1)写出你从图中能得到的信息(写出一条即可)。
(2)采取哪些方法可将B的不饱和溶液转为饱和溶液。
(只写一种方法)
(3) t2℃时,A物质饱和溶液中溶质的质量分数是多少?
2010年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ▲ ;
(2)求样品中碳酸钙的质量分数;
中国核潜艇技木世界领先。在潜艇中常用过氧化钠吸收二氧化碳并产生氧气来维持艇内空气成分平衡,其反应的化学方程式为:2Na202+CO2=2Na2CO3+O2.现有
质量分数为78%的过氧化钠100g.与足量的二氧化碳反应,可生成氧气多少克?(杂
质不参加反应)
Ag-Zn合金可用于工艺品的制作。某化学兴趣小组的同学为了测定某银锌合金的组成,取一定量样品于烧杯中,向其中分5次加入相同质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量均为20g,剩余固体的质量记录于下表:
| 实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 反应后剩余固体的质量(g) |
17.4 |
14.8 |
12.2 |
10.8 |
10.8 |
试回答下列问题(填写数据一定要有单位!):
①该样品中银的物质的量为 (34) ;实验用样品的总质量是 (35) 。
②有同学认为没有必要进行第五次的实验,你的理由是 (36) ;
③计算所用稀硫酸溶质的质量分数,除需用到稀硫酸溶液的质量为20g,还需要用到表格中的数据有(37) (多选不给分!)。