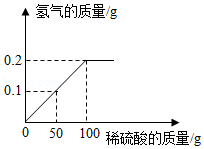
铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢气的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为 g。
(2)合金样品中锌的质量。
(3)恰好完全反应时,所得溶液溶质的质量分数。(结果保留一位小数)
硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用.取8.5%的过氧化氢溶液40g倒入小烧杯中,向其中加入20%的硫酸铜溶液6.6g,使过氧化氢完全分解.计算:
(1)产生氧气的质量.
(2)反应后所得溶液中硫酸铜的质量分数.
现有硫酸钠和硫酸镁固体混合物8 g,向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到2.9g沉淀和溶质质量分数为10 %的滤液。求:
(1)混合物中硫酸镁的质量分数;
(2)加入氢氧化钠溶液的溶质质量分数(计算结果精确到0.1%(。
(4分)100g的稀硫酸与13g的锌正好完全反应,请计算:
(1)生成氢气的质量(结果精确到0.1g)
(2)反应后所得溶液中溶质质量分数(结果精确到0.1%)。
已知硫酸铵的化学式(NH4)2SO4,试计算:
(1)硫酸铵的相对分子质量?
(2)硫酸铵中各元素的质量比?
(3)264千克含硫酸铵90%的硫铵化肥中含氮元素多少千克?
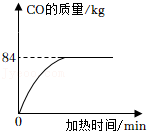
我国明代科技著作《天工开物》中有利用炉甘石(主要成分是ZnCO3)火法炼锌的工艺记载,主要反应原理为ZnCO3+2C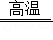 Zn+3CO↑,现用200kg炉甘石与足量碳充分反应,产生CO的质量与加热时间的关系如图所示。
Zn+3CO↑,现用200kg炉甘石与足量碳充分反应,产生CO的质量与加热时间的关系如图所示。
(1)此过程中产生CO的质量是 kg。
(2)列式计算此炉甘石中ZnCO3的质量分数。
某钢铁厂每天需消耗1000t含氧化铁80%的赤铁矿石,该厂理论上可以炼出含铁96%的生铁的质量是多少?
生铁和钢都是铁合金,生铁中碳的含量在2.0%~4.3%之间,钢中碳的含量在0.03%~2%之间。某兴趣小组同学取铁合金样品5.7g(假设只含铁单质及碳单质),加入稀硫酸至不再产生气体为止,反应过程中生成的气体与所加稀硫酸酸的质量关系如图所示。根据计算回答(计算结果保留一位小数):
(1)该铁合金是生铁还是钢?
(2)加入的稀硫酸中溶质的质量分数?
(3)反应后所得溶液中溶质的质量分数?
乙醇( )俗称酒精,可通过高粱、玉米和薯类等发酵、蒸馏而得到,属于可再生能源。
(1)乙醇中碳、氢元素的原子个数比是 。
(2)乙醇中碳元素的质量分数是 (计算结果精确到0.1%)。
某保健品主要成分为碳酸钙,请完成下列问题:
(1)碳酸钙的化学式为CaCO3,其相对分子质量为 钙、碳、氧元素的质量比为
(2)碳酸钙中钙元素的质量分数是
(3)某儿童现需要补充钙元素200mg,则该儿童需食用该碳酸钙 克
某补钙剂标签上对所含的成分有如下说明:每片含主要成分碳酸钙1.5g(相当于钙600mg)。某同学要探究该钙片的主要成分含量是否准确,他取出10片钙片,加入足量的稀盐酸,充分反应,收集到6.6g二氧化碳(假定其它成分不与盐酸反应)。试计算:
(1)每片含碳酸钙的质量是多少?
(2)每片含钙元素的质量是多少?
(3)通过计算,你得出什么结论?
某化工厂怀疑采购来的烧碱有部分变质,工厂技术员为了测定其变质情况,即测定烧碱的纯度(假设样品中只有氢氧化钠和碳酸钠这两种成分,且碳酸钠是变质产生的),做了如下实验:取烧碱样品20g,分四次加入到36.5g一定浓度的稀盐酸中,数据如下表所示
| 实验次数 |
1 |
2 |
3 |
4 |
| 每次加入样品的质量/g |
5 |
5 |
5 |
5 |
| 反应后剩余物质的总质量/g |
40.4 |
44.3 |
m |
54.3 |
请根据提供的数据,回答下列问题:
(1)表格中m的数值为 。
(2)请计算烧碱样品中烧碱的纯度。
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用如下办法:取用8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。
| 序号 |
加入稀盐酸质量(g) |
剩余固体质量(g) |
| 第1次 |
10 |
5.5 |
| 第2次 |
10 |
m |
| 第3次 |
10 |
1.2 |
| 第4次 |
10 |
n |
请计算:(1)表中m的数值为 ;n的数值应该为 ;
(2)样品中碳酸钙的质量分数是 ;
(3)通过计算,求反应中生成二氧化碳气体的质量。