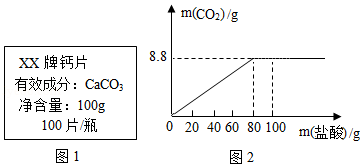
钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
| 实验次数 |
第一次 |
第三次 |
第四次 |
| 加入盐酸的质量(g) |
20 |
20 |
20 |
| 剩余固体的质量(g) |
35 |
a |
20 |
(1)该品牌补钙药剂中CaCO 3的质量分数是 ,a的数值为 。
(2)该盐酸中溶质的质量分数是多少?(写出计算过程,计算结果精确至0.1%)
向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数的稀盐酸,充分反应后烧杯内物质总质量变化如图所示。
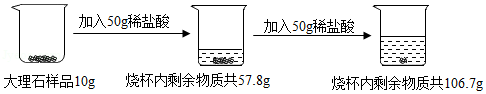
请计算:
(1)该大理石样品中碳酸钙的质量分数是 ;
(2)计算所用稀盐酸的溶质质量分数。
维生素C又称﹣﹣抗坏血酸,化学式为C6H8O6,是一种抗氧化剂,保护身体免于自由基的威胁。请回答下列问题
(1)维生素C的相对分子质量为 ;
(2)维生素C中碳元素和氢元素的质量比为 (填写最简整数比);
(3)88g维生素C中含有的碳元素的质量是 g。
工业上电解氧化铝制取金属铝的化学方程式2Al 2O 3  4Al+3O 2↑ 电解20t氧化铝最多可生产多少吨铝?(写出必要的计算过程,计算结果精确到0.1t)
4Al+3O 2↑ 电解20t氧化铝最多可生产多少吨铝?(写出必要的计算过程,计算结果精确到0.1t)
将91.6g氢氧化钾溶液与一定质量的氯化镁溶液混合,恰好完全反应,过滤后,得到11.6g沉淀和280g滤液,求氯化镁溶液的溶质质量分数.
为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:
(1)实验中生成氢氧化铜的质量为 g;
(2)300g该废水中硫酸铜的质量;
(3)该废水中硫酸的溶质质量分数。(计算结果精确到0.1%)

维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、 、维生素、无机盐和水.α﹣丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注"﹣"表示原子之间相互连接),试计算:
(1)α﹣丙氨酸的化学式量(或相对分子质量)为 ;
(2)α﹣丙氨酸中碳元素、氢元素、氧元素的质量比为 ;
(3)17.8gα﹣丙氨酸中含氮元素的质量为 g.

向53g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为5%的稀盐酸,生成二氧化碳的质量随加入盐酸质量的变化关系如图所示。(不考虑CO 2的溶解)
已知:
OB段反应的化学方程式为Na 2CO 3+HCl═NaCl+NaHCO 3
BD段(不含B点)反应的化学方程式为NaH CO 3+HCl═NaCl+H 2O+CO 2↑
请回答:
(1)53g质量分数为10%的碳酸钠溶液中溶质质量为 g。
(2)A点对应溶液中溶质有 (填化学式)。
(3)B点横坐标为 (计算结果保留1位小数,下同)
(4)假设C点横坐标为54.75,计算C点对应的二氧化碳质量。(写出计算过程)

2015年5月中国自主知识产权抗癌新药"西达苯胺"全球上市。我国有了自己原创的抗癌新药。某种西达苯胺(化学式为C 22H 19FN 4O 2)药片中,除了含有西达苯胺外,还含有淀粉。
(1)西达苯胺的相对分子质量为 。
(2)药厂检验室对该西达苯胺药片进行检验,若测得药片中氟元素的含量为  ,则该药片中西达苯胺的质量分数是多少?
,则该药片中西达苯胺的质量分数是多少?
小苏打是发酵粉的主要成分之一,可用于制作发面食品。一化学兴趣小组对某小苏打样品中各成分的含量做了如下测定:将一定质量的该样品(已知杂质只含NaCl)加水全部溶解后,得到104.4g溶液,向该溶液中逐渐加入稀盐酸,产生的气体与加入稀盐酸的质量关系如图所示。试计算:
(1)m的值为 。
(2)当恰好完全反应时,所得溶液的溶质质量分数为3%,求原小苏打样品中NaHCO 3与NaCl的质量比 。

小兰进行水的电解实验时,在水中加入少许硫酸钠以增强导电性。她将2.7g硫酸钠固体加入52.7g水中充分溶解,倒入电解器中通电,当正极产生4.8g氧气时结束实验。忽略气体在水中的溶解,请计算(写出计算过程):
(1)负极产生氢气的质量;
(2)实验结束时所得溶液的溶质质量分数。
诺贝尔生理学和医学奖的一次重大失误是1948年授予了瑞士化学家米勒,他发明的剧毒有机氯杀虫剂DDT (化学式C 14H 9Cl 5)带来了许多环境问题,后来被禁用。试计算:
(1)一个DDT分子是由 个原子构成;
(2)DDT中碳元素和氢元素的质量比为 (填最简整数比)。
氧化钴(CoO)溶于盐酸可得到粉红色的氯化钴(CoCl 2)溶液。CoCl 2含结晶水数目不同而呈现不同颜色。利用蓝色的无水CoCl 2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的六水氯化钴晶体(CoCl 2•6H 2O)受热分解时,剩余固体质量随温度变化的曲线。
已知:①CoCl 2•6H 2O的相对分子质量为CoCl 2和6个结晶水的相对分子质量之和。

②CoCl 2•6H 2O受热分解完全脱水的化学方程式为:CoCl 2•6H 2O  CoCl 2+6H 2O。
CoCl 2+6H 2O。
请回答:
(1)CoCl 2的钴元素的化合价为 价。
(2)求物质A(CoCl 2•xH 2O)中的x值。