为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如图实验,请结合实验回答下列问题:

(1)上述实验过程中发生反应的化学方程式为 。
(2)产生氧气的质量为 g。
(3)根据生成氧气的质量列出求解参加反应的过氧化氢质量(x)的比例式 。
(4)计算上述过氧化氢溶液中溶质的质量分数,并填写在答题卡的标签上(标签样式如图) 。

(5)若配制上述浓度的过氧化氢溶液300g,需要30%的过氧化氢溶液 g。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

小明用石灰石测定某稀盐酸中溶质的质量分数,向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
| 实验次数 |
第一次 |
第二次 |
| 石灰石粉末质量/g |
15 |
15 |
| 烧杯中物质总质量/g |
109.5 |
121.2 |
(1)共生成二氧化碳 g。
(2)所用稀盐酸中溶质的质量分数。
绿色环保是未来工业发展的方向,我市锰矿资源丰富,某电解锰厂排放的废液中可能含有少量硫酸,某校兴趣小组同学取该废液样品100g,加入某碱性M物质充分反应后得到的相关数据如图(废液中其它物质不与M物质反应)。请根据相关知识和图表信息回答下列问题。
(1)从经济和效果考虑,该电解锰厂应选择什么物质除去废液中硫酸?
(2)该反应的基本类型是 。
(3)计算废液中硫酸的质量分数(写出计算过程)。

某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
| 加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
| 充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
现有碳酸钾和氯化钾的固体混合物15.8g,将88.6g稀盐酸加入到固体混合物中,恰好完全反应,得到100g溶液。请计算:
(1)反应生成的气体的质量为 。
(2)混合固体中碳酸钾的质量为 。
(3)计算反应后溶液中溶质的质量分数。(写出计算过程)有
请根据所示的实验过程和提供的信息作答:
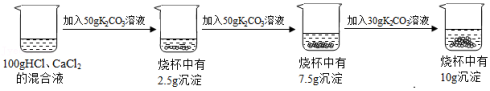
(1)K2CO3中钾、碳、氧元素的质量比为 (写最简比)。
(2)实验结束后溶液中的溶质为 。
(3)实验所用K2CO3溶液的溶质质量分数为 (精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)
现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 。
(2)反应后所得溶液中氢氧化钠的质量。
胆矾(CuSO4•5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 (填“强”或“弱”)。
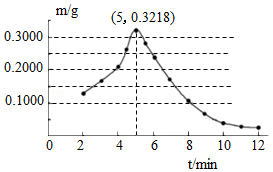
(2)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
①加热至 ℃时,CuSO4开始分解。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 。CuO完全分解时产生该气体的质量为 g。
③根据胆矾分解的化学方程式CuSO4•5H2O CuSO4+5H2O,计算图中x的值(写出计算过程)。
CuSO4+5H2O,计算图中x的值(写出计算过程)。
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 (填字母序号)。
a.CuSO4•5H2O
b.CuSO4
c.CuO
d.Cu2O

我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,已称取样品6g,放入40g水中使其完全溶解,再加入稀盐酸26.2g,恰好完全反应,气体全部逸出,得到氯化钠的不饱和溶液70g。请计算(写出简要的计算过程):
(1)生成二氧化碳的质量。
(2)样品中碳酸钠的质量。
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
“7150灭火剂”(C3H9B3O6,相对分子质量为174)以雾状形式喷射到燃着的金属时,立即发生燃烧反应:2C3H9B3O6+9O2 3B2O3+9H2O+6CO2。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物品表面而隔绝空气,从而有效灭火。若充分燃烧348g“7150灭火剂”,会消耗常温下的氧气多少升?(常温下氧气密度约为1.4g•L﹣1,结果保留一位小数)
3B2O3+9H2O+6CO2。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物品表面而隔绝空气,从而有效灭火。若充分燃烧348g“7150灭火剂”,会消耗常温下的氧气多少升?(常温下氧气密度约为1.4g•L﹣1,结果保留一位小数)
《天工开物》中记载了金属的冶炼技术。在锌的冶炼方法中,主要反应之一为ZnO+CO Zn+CO2。若制得65kgZn,计算参加反应的ZnO的质量(写出计算过程及结果)。
Zn+CO2。若制得65kgZn,计算参加反应的ZnO的质量(写出计算过程及结果)。
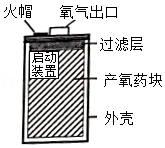
某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是 。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸2小时所需氧气的量(折算后质量为48g),计算产氧药块中至少含氯酸钾的质量(写出计算过程)。
关于燃烧的研究是一项重要的课题。某小组以“探究燃烧的奥秘”为主题开展项目式学习。
【任务一】认识燃烧
(1)酒精、煤(含硫)、天然气是生活中常见的燃料,下列不属于三者燃烧共有的现象是 (填字母序号)。
A.发光
B.产生有刺激性气味的气体
C.放热
D.产生使澄清石灰水变浑浊的气体
(2)写出酒精(C2H5OH)完全燃烧的化学方程式 。
【任务二】探究燃烧的条件及质量变化
(3)该小组同学按下列实验步骤开展探究。
步骤1:室温下,按如图组装装置,装入药品,称量装置总质量为m1g。
步骤2:将锥形瓶浸入80℃的热水中,观察现象。
步骤3:取出装置,恢复至室温并擦干锥形瓶;打开止水夹K1和K2,从K1处缓慢通入约50mL氧气,再关闭K1和K2,称量装置总质量为m2g。
步骤4:将锥形瓶再次浸入80℃的热水中,观察现象。
步骤5:取出装置,恢复至室温并擦干锥形瓶,称量装置总质量为m3g。
①通过上述实验,能证明燃烧需要氧气的实验现象是 。
②m1、m2、m3的大小关系是 。
【任务三】调控燃烧
(4)报道显示:国内外一些煤田因发生煤层自燃,带来了资源浪费和环境污染。一旦煤层自燃,请给出一条合理的灭火建议 。
【任务四】再探铁的燃烧
(5)查阅文献:颗粒直径为20~30nm的铁粉,在空气中会发生自燃生成氧化铁。
结合已有知识,回答下列问题:
①影响铁燃烧的因素有 (至少答出2点)。
②铁与氧气反应的条件不同,产物不同。若5.6g铁与氧气反应可得ag产物,且铁无剩余,则a的取值范围是 。
