我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L。
(1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g。
(2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算:
①石灰石中CaCO3的质量分数;
②反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。
甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:
计算:
(1)金属混合物铁的质量分数;
(2)甲制得硫酸亚铁的质量;
(3)该稀硫酸的质量分数。
(6分)某学校化学兴趣小组的同学想测定赤铁矿中氧化铁的含量,做了如下实验:首先称取100 g该赤铁矿样品放入烧杯中,然后将500g的稀盐酸分5次加入烧杯内(假设其余杂质均不与盐酸反应也不溶于水)进行充分反应。实验过程中的数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 稀盐酸的质量 |
100g |
100g |
100g |
100g |
100g |
| 溶液的质量 |
116.0g |
X |
348.0g |
464.0g |
575.0g |
请回答下列问题:
(1)该小组要用质量分数为36.5%浓盐酸配制所需的500g的稀盐酸,则需浓盐酸的质量为_____
(2)写出实验中发生反应的化学方程式 ____________________
(3)列出求解生成氯化铁总质量的比例式 ____________________
(4)将第二次反应后所得溶液蒸发掉32g水(未达到饱和),则所得溶液的溶质质量分数是________
(5)某工厂要想制得420t含杂质3%的生铁,需要这种赤铁矿的质量为 ___________
人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是 (填序号)。
Ⅱ.铁是应用最广泛的金属。
(1)下图是工业炼铁示意图。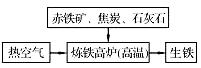
其中,焦炭的作用是燃烧提供能量和 ;
写出有铁生成的化学方程式 。
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。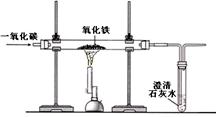
①实验中玻璃管里固体粉末的颜色变化是 ,澄清的石灰水中发生反应的化学方程式是 。
②该装置有何不妥? 。
(3)该化学兴趣小组的同学利用改正后的装置进行探究用500g含氧化铁质量分数为70%的赤铁矿,可以炼出含杂质4%的生铁多少克?
2010年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ;
(2)碳酸钙恰好完全反应时消耗稀盐酸 g;
(3)求样品中碳酸钙的质量分数为多少?
“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下:
请回答下列问题:
(1)H2O2在催化或受热条件下易分解,说明化学变化的速度和 相关;
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是 (填序号)。
| A.二氧化锰 |
B.稀盐酸 |
C.硫酸钠 |
D.石灰水 |
(3)“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3.3H2O2)==4Na2CO3+6H2O+3O2↑
请通过计算说明(必须有计算的过程):
①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是多少?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,共需水多少毫升?
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如下图所示。
回答下列问题:
(1)从图中看出生成沉淀的最大质量是 g。
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原
因是 。
(3)计算原滤液中氯化钙的质量分数。
用 溶液测定某种氮肥中 的质量分数(杂质溶于水,但不参加反应).
实验如下:称取该氮肥20
加水完全溶解,向该溶液中不断滴入
溶液,生成气体及沉淀质量与加入
溶液的质量关系如下所示:

| 实验次序 |
1 |
2 |
3 |
| 滴入 溶液的质量 | 20 |
40 |
60 |
| 生成气体的质量 | 0.85 |
2.55 |
试分析并计算:【已知:
】
(1)表格中
的值为
.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中 的质量分数.(计算结果精确至0.1 )
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)小明要从反应后的溶液中提取NaCl应采用的方法是 ;
(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸:
(1)先将黄铁矿石粉碎的目的是 。
(2)写出稀释浓硫酸的具体操作步骤 。
(3)将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
(4)取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
重铬酸钾( ,铬元素为 价, 表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但 价格有很强的毒性易污染环境,使用后,须用绿矾,( )将其变成毒性 价格才能做后续处理.反应原理是: 现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
实验室用50g溶质质量分数为19.6%的稀硫酸与足量的锌粒充分反应,可以生成氢气多少克?
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)
已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度
时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(
)固体;温度
时,草酸亚铁完全分解,发生反应:
.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成
的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).

Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,某化学兴趣小组的同学为了测定某黄铜的组成取10g该黄铜样品于烧杯中,向其中5次加入相同溶质质量分数的稀H2SO4,使之充分反应,见下表:
| |
加入稀酸硫/g |
充分反应后剩余固体质量/g |
| 第1次 |
10 |
M |
| 第2次 |
10 |
7.4 |
| 第3次 |
10 |
6.1 |
| 第4次 |
10 |
5.6 |
| 第5次 |
10 |
5.6 |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6克固体的成分是________________,m=________________。
(2)黄铜样品中锌的质量分数。
(3)计算所用稀硫酸中硫酸的质量分数。