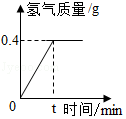
氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H 2O  Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,生成氢气的质量是 g。
(2)氯化钠完全反应时,生成氢氧化钠的质量是 g。
(3)原氯化钠溶液中溶质的质量分数是多少?
用某含有CO 2、水蒸气的还原性气体(可能含有CO、H 2中的一种或两种)经过如图的装置来确定其成分及C装置中Fe xO y的化学式。
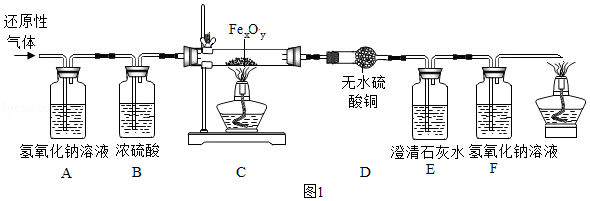
(1)B装置的作用是 ,D装置的作用 。
(2)实验过程中观察到D中无明显变化,若澄清石灰水变浑浊,则还原性气体是 ,当C中的Fe xO y完全反应后,测得E和F的总质量增加3.52g,C中剩余固体质量为3.36g,则Fe xO y的化学式为 ,若没有A装置,则测得的x和y的比值将 (填"偏大"、"偏小"或"不变")。
上述实验中生成的二氧化碳用氢氧化钠溶液吸收,某工厂也利用此原理吸收生产中排放的二氧化碳,再通过一定的方法将二氧碳释放、储存达到回收再利用的目的,具体流程如图1(部分反应条件和试剂未标出)
根据图2回答下列问题
(3)分离池中发生的化学反应方程式为 。
(4)B为 (填化学式)
(5)"人类只一个地球!"防止温室效应的根本对策是全球参与控制二氧化碳的排放量","低碳生活从我做起"。请举出一例"低碳"生活的例子 (合理即可)。 
某石灰水中含有氢氧化钙0.74g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是多少?
生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%﹣4.3%,钢含碳量为0.03%﹣2%).将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2g,通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)
小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作"叶脉书签"(杂质不参加反应)。操作过程如下:
请计算:

(1)20g样品中碳酸钠的质量为 g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
(3)将200g滤液浓缩成制作"叶脉书签"所需质量分数为10%的氢氧化钠溶液,需蒸发水 g。
小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作"叶脉书签"(杂质不参加反应)。操作过程如下:
请计算:

(1)20g样品中碳酸钠的质量为 g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
(3)将200g滤液浓缩成制作"叶脉书签"所需质量分数为10%的氢氧化钠溶液,需蒸发水 g。
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
| 样品编号 |
① |
② |
③ |
④ |
| 稀盐酸的质量 |
25g |
50g |
m(80<m<150) |
150g |
| 剩余固体的质量 |
7.5g |
5g |
2g |
2g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的 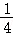 于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为 .
(2)编号③所用稀盐酸的质量m为 g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
实验室取68g过氧化氢溶液和2g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4g.求:
(1)充分反应后,生成氧气的质量为 g;
(2)参加反应的过氧化氢溶液中溶质的质量分数.
"氯碱工业"是最基本的化学工业之一,它的主要原理是电解饱和食盐水,其反应的化学方程式:2NaCl+2H 2O  2NaOH+H 2↑+Cl 2↑.在20℃时,取一定量的饱和NaCl溶液进行电解,一段时间后测得产生氯气(化学式为Cl 2)14.2kg.请你计算.在上述过程中同时产生氢氧化钠的质量是多少?
2NaOH+H 2↑+Cl 2↑.在20℃时,取一定量的饱和NaCl溶液进行电解,一段时间后测得产生氯气(化学式为Cl 2)14.2kg.请你计算.在上述过程中同时产生氢氧化钠的质量是多少?
为测定某BaCl 2溶液的溶质质量分数,进行如下实验:取104g该溶液于烧杯中,加入1g稀硝酸溶液酸化,无任何现象,然后将30g一定溶质质量分数的硫酸溶液分三次加入,每次充分反应后过滤、称量(实验中物质的质量损失忽略不计),数据如表:
| |
第1次 |
第2次 |
第3次 |
| 加入硫酸溶液的质量/g |
10 |
10 |
10 |
| 过滤后溶液的质量/g |
105 |
105 |
111.7 |
根据以上数据计算:(BaCl 2+H 2SO 4═BaSO 4↓+2HCl)
(1)该实验过程中产生沉淀的总质量为 g.
(2)该BaCl 2溶液中溶质的质量分数(写出计算过程)
某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如表:
| 实验序号 |
消耗NaOH溶液的质量 |
洗涤后溶液的pH |
| ① |
30g |
pH<7 |
| ② |
40g |
pH=7 |
| ③ |
50g |
pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H 2SO 4的质量,你觉得应该选择实验序号 的数据.
(2)若一定量石油产品中残余硫酸的质量为100g,请计算该残余硫酸的溶质质量分数(写出详细的计算过程)
某化学小组将稀盐酸滴入一定量的碳酸钙样品(杂质不与盐酸反应)中制取CO 2.产生CO 2的质量与滴入稀盐酸的质量关系如图所示,请回答:
(可能用到的相对原子质量:H﹣1 C﹣12 O﹣16 Cl﹣35.5)
(1)该试验最多制得CO 2得质量为 g.
(2)计算所滴加的盐酸中溶质的质量分数.(要求有计算过程)

某化学兴趣小组参观了一个石灰厂时,带回了一些石灰石样品,同学们利用这些石灰石样品做了如下实验:取样品10g放入烧杯中,将50g稀盐酸分5次加入,实验过程所得的数据如表所示(已知石灰石样品中的杂质不参与反应,也不溶于水)。根据实验数据计算:
| 实验次数 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
| 1 |
10 |
8 |
| 2 |
10 |
6 |
| 3 |
10 |
4 |
| 4 |
10 |
2 |
| 5 |
10 |
2 |
(1)第 次加入稀盐酸充分反应,CaCO 3恰好完全反应;
(2)石灰石样品中CaCO 3的质量分数= ;
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)。
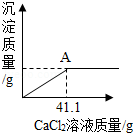
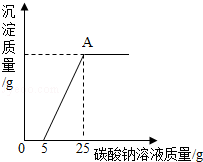
某化学课外活动兴趣小组的同学,对某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl 2溶液(实验中产生的沉淀与加入CaCl 2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计)。试求:
(1)完全反应后,所得滤液中水的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数为多少? 。(无计算过程不给分)