某化工厂的废水中含少量氢氧化钠,技术人员欲测其含量。取废水20g,向其中逐滴滴加9.8%的稀硫酸,利用pH传感器测定溶液pH变化如图所示。通过计算判断该废水是否可以直接排放?(排放标准:废水中氢氧化钠的质量分数<0.001%)

请你仔细分析如图所示的实验过程和提供的数据,并进行计算。

(1)反应后烧杯中溶液质量为 g。
(2)反应后所得溶液的溶质质量分数(写出计算过程,精确到0.1%)。
某化工产品的成分是碳酸钙、氢氧化钙和硫酸钡,现取该化工产品样品20g放入锥形瓶内,向其中加适量水,振荡,然后再向锥形瓶中滴加溶质质量分数为10%的稀盐酸,反应生成二氧化碳的质量与加入稀盐酸的质量关系如图所示。请回答下列问题:
(1)该样品中钙元素的质量分数是 (只填空,不列式计算)。
(2)计算该样品中氢氧化钙的质量。

2020年6月8日是第12个"世界海洋日",海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料﹣﹣氯化镁,设计方案如图:

【信息】1.海水和苦卤中都含有NaCl、Na 2SO 4、MgCl 2、CaCl 2、KCl等。
2.苦卤是海水晒盐后剩余的溶液。
3.下表是某品牌不同碱的价格。
| 试剂 |
NaOH |
Ca(OH) 2 |
Ba(OH) 2 |
KOH |
| 价格(元/吨) |
2400 |
850 |
5300 |
5500 |
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是 。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是 。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。(写出计算步骤)
生铁是由铁和碳组成的合金。某化学兴趣小组的同学为了测定某稀盐酸中溶质的质量分数,取一定量的该生铁样品,分四次加入稀盐酸200g,充分反应后,实验数据如下:
| 次数 |
1 |
2 |
3 |
4 |
| 稀盐酸质量/g |
50 |
50 |
50 |
50 |
| 氢气质量/g |
0.2 |
m |
0.2 |
0.1 |
请根据有关信息完成下列问题:
(1)m= 。
(2)该稀盐酸中溶质的质量分数。(请写出计算过程,计算结果精确到0.1%)
生铁和钢都是铁和碳的合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%.化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
| 次数 |
加盐酸前 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的质量(g) |
0 |
20 |
20 |
20 |
20 |
20 |
| 锥形瓶内物质的总质量(g) |
11.5 |
31.4 |
m |
71.2 |
91.1 |
111.1 |
【查阅资料】碳不与稀盐酸反应。
请回答下列问题:
(1)根据质量守恒定律,该反应中生成气体的总质量为 。
(2)实验数据表中m的值为 。
(3)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
"蛟龙号"是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na 2O 2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96g氧气,则至少需要多少克过氧化钠?
某纯碱样品中含有少量的氯化钠,某化学兴趣小组欲测定其中碳酸钠的质量分数。他们称取6.0g样品放入锥形瓶中,加入稀硫酸直到不再产生气体为止,反应中生成气体的质量与加入稀硫酸的质量关系如图所示:
计算:
(1)反应生成的二氧化碳的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数(写出计算过程,计算结果精确到0.1%)。
(反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O)

称取5g含杂质的氢氧化钙固体样品放入烧杯中,向烧杯中加入50g溶质的质量分数为7.3%的稀盐酸(假设杂质不与稀盐酸反应),二者恰好完全反应。请计算:固体样品中氢氧化钙的质量分数。
赤铁矿石的主要成分为氧化铁。将10g赤铁矿石样品(杂质既不溶于水,也不参加反应)放入烧杯中,再加入92g稀硫酸,恰好完全反应,过滤,得到滤液和2g滤渣。请计算:
(1)赤铁矿石样品中氧化铁的质量分数。
(2)反应后所得溶液中溶质质量分数。
某公司生产的新型融雪剂,其成分是无水CaCl 2和少量的NaCl,为测定CaCl 2的含量,同学称取该样品12g,加水充分溶解成溶液,然后取一定质量分数的Na 2CO 3溶液分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
| 次数 |
1 |
2 |
3 |
4 |
5 |
| 加入Na 2CO 3溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
| 生成沉淀的质量/g |
2.5 |
x |
7.5 |
10 |
10 |
(1)上表x= 。
(2)样品中CaCl 2的质量分数。
取一定量氯化镁溶液于烧杯中,将100g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
| 实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入的氢氧化钠溶液质量/g |
20 |
20 |
20 |
20 |
20 |
| 沉淀总质量/g |
2.9 |
5.8 |
8.7 |
11.6 |
11.6 |
分析上表中的数据,完成下列问题:
(1)第 次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为 g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4g,求原氯化镁溶液中溶质的质量分数(请写出计算过程)。
为了测定一瓶标签被腐蚀的稀硫酸中溶质的质量分数,桢桢同学用小烧杯取了16g10%的NaOH溶液,并向其中逐滴加入该稀硫酸,反应过程中溶液的pH与滴入稀硫酸的质量关系如图所示,计算:
(1)该稀硫酸的溶质的质量分数。
(2)当滴入稀硫酸质量为4g时烧杯内溶液中钠元素的质量(写出简单的计算过程)

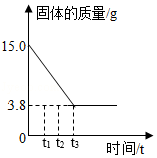
取15g某铁样品(杂质不溶于水也不与酸反应)放入烧杯中,逐渐加入一定质量的稀盐酸至不再产生气泡,烧杯中固体的质量随反应时间的关系如图所示。过滤后向所得滤液中加入143.2g水,测得溶液的溶质质量分数为10%,计算:
(1)该样品中铁的质量。
(2)所用稀盐酸的溶质质量分数。