设计实验方案是科学探究的重要环节,以下化学实验设计中,不能达到实验目的的是
| A.厨房中用食醋鉴别纯碱和食盐 |
| B.用AgNO3溶液鉴别H2中混入的少量HCl杂质 |
| C.用稀硫酸除去铁粉中混有的少量铜粉 |
| D.用稀盐酸检验暴露在空气中的NaOH固体是否变质 |
下列有关物质鉴别方案正确的一组是
| A.MgCl2溶液、NaOH溶液、H2SO4溶液、CuSO4溶液,不加任何试剂即可鉴别 |
| B.可用Ba(OH)2溶液鉴别(NH4)2CO3、(NH4)2SO4、NH4NO3三种氮肥 |
| C.Na2CO3溶液、Ca(OH)2溶液、盐酸、BaCl2溶液,不加任何试剂即可鉴别 |
| D.CuO粉末、炭粉、铁粉,三种黑色粉末用一种试剂就可鉴别 |
下列各组物质在溶液中能大量共存且形成无色溶液的是
| A.NaCl BaCl2 Na2CO3 | B.KNO3 HCl CaCl2 |
| C.H2SO4 FeCl3 NaNO3 | D.NaOH HNO3 NH4NO3 |
除去以下物质中的少量杂质,所用试剂及方法正确的是
| 选项 |
物质 |
杂质 |
所用试剂及方法 |
| A |
|
通入足量的
溶液 |
|
| B |
溶液 |
稀盐酸 |
加入过量的
,过滤 |
| C |
溶液 |
溶液 |
加入足量的
粉,过滤 |
| D |
溶液 |
溶液 |
加入适量的
溶液,过滤 |
向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是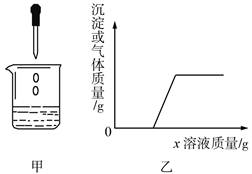
| |
烧杯中的物质 |
x溶液 |
| A |
稀盐酸和硫酸铜溶液 |
烧碱溶液 |
| B |
稀硫酸和稀盐酸 |
氯化钡溶液 |
| C |
镁铝合金 |
稀盐酸 |
| D |
氯化钠和碳酸氢钠溶液 |
稀盐酸 |
某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种;某无色溶液乙是初中化学常见的一种可溶性钡盐溶液。为探究白色固体甲的成分,进行如下实验。对于固体甲的分析错误的是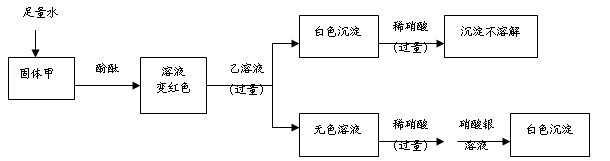
| A.一定有硫酸钠 |
| B.一定有氢氧化钠 |
| C.若乙溶液为硝酸钡溶液,一定有氯化钠 |
| D.至少含有碳酸钠、氢氧化钠中的一种 |
硝酸钾是一种重要的化工产品,工业上制备硝酸钾的流程图如下:
下列说法正确的是
| A.操作I、II、III、 IV都是过滤 |
| B.①中反应为:CaS04+2NH4HC03=CaC03↓+(NH4)2S04+H20+C02↑ |
| C.滤渣2可以循环利用 |
| D.反应④后需要热过滤的原因是加快过滤速率 |
某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是
| A.肯定含有硝酸钾,可能含有硝酸钡 |
| B.肯定含有碳酸钠,可能含有硝酸钡 |
| C.不含硫酸铜和硝酸钡,只含碳酸钠 |
| D.肯定含有碳酸钠,可能含有硝酸钾 |
下列各组溶液,不用其他试剂就能鉴别出来的是()
| A. | 、 、 、 |
| B. | 、 、 、 |
| C. | 、 、 、 |
| D. | D. 、 、 、 |
某混合物中含有氯化钡和氯化钠,取该混合物16.25g,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,恰好完全反应,产生9.85g沉淀。计算
(1)所取混合物中氯化钠的质量分数。
(2)所加碳酸钠溶液的质量。
(3)当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少。(计算结果精确到0.01%)
如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种.图中相连的两圆表示相应物质能发生反应,已知乙是铁.下列说法错误的是()
| A. | 五种物质中,只有铁是单质 | B. | 丙是盐酸 |
| C. | 戊是氢氧化钙 | D. | 甲与丁反应属于复分解反应 |
下列图像与所述实验相符的是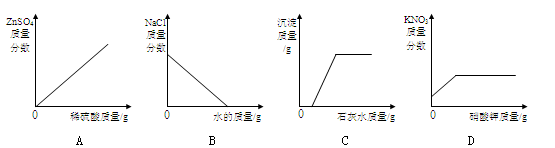
| A.向一定量锌粒中加入过量稀硫酸 |
| B.向一定量氯化钠饱和溶液中不断加水 |
| C.向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水 |
| D.20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体 |
向含有稀盐酸和氯化铜的混合溶液中滴加NaOH溶液,如图曲线中描述正确的是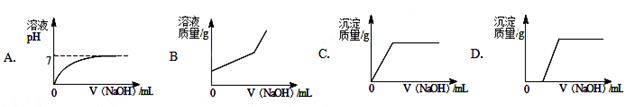
下表所列实验设计及操作,其现象足以说明结论的是()
| 选项 |
操作 |
现象 |
结论 |
| A |
向某种化学肥料中加入熟石灰混合、研磨 |
没有氨味 |
该化学肥料一定不是氮肥 |
| B |
点燃某种纤维材料 |
无烧焦羽毛的气味 |
该纤维一定是合成纤维 |
| C |
向一未知溶液中加入稀盐酸 |
有无色气泡产生 |
该溶液中一定含有
|
| D |
向一未知溶液中先滴加足量稀盐酸,再滴加BaC12溶液 |
先无现象,后产生白色沉淀 |
原溶液中一定含有
|
| A. |
A |
B. |
B |
C. |
C |
D. |
D |