江苏省镇江市九年级化学适应性训练(二)试卷
下列关于饮食健康的说法错误的是
| A.每天都应摄入一定量的蛋白质 | B.油脂会使人发胖,故禁食油脂 |
| C.应补充一定量的粗粮及蔬菜 | D.过多摄入微量元素不利于健康 |
大量使用塑料袋会造成“白色污染”,常见的非食品包装袋主要是聚氯乙烯塑料(PVC)其化学式 为(C2H3Cl)n。下列有关聚氯乙烯的说法,不正确的是
A.各元素的质量比为2: 3:1 B.相对分子质量为62.5n
C.它属于有机合成材料 D.完全燃烧时有二氧化碳生成
下列归类错误的是
| 选项 |
归类 |
物质(或元素) |
| A |
常见合金 |
黄铜、硬铝、钢 |
| B |
构成物质的基本微粒 |
分子、原子、离子 |
| C |
常见氮肥 |
碳酸氢铵、硫酸铵、尿素 |
| D |
大气污染物 |
二氧化硫、二氧化碳、粉尘 |
下列图示的实验操作正确的是
| A.O2验满 | B.实验室制CO2 | C.浓硫酸的稀释 | D.收集SO2并处理尾气 |
下列说法错误的是
| A.误食重金属盐,可立即服用蛋清或牛奶解毒 |
| B.利用洗洁精的乳化作用可以洗去餐具上的油污 |
| C.明矾既能净水又能杀菌消毒 |
| D.用水可以鉴别NH4NO3、NaOH、NaCl三种固体 |
如图是一定条件下某化学反应的微观模拟示意图,下列说法错误的是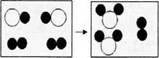
| A.该反应是化合反应 |
| B.参加反应的两种物质的分子个数比为1:1 |
| C.该反应前后,原子种类、数目不变 |
| D.该示意图中共有3种分子 |
下列有关实验现象的描述正确的是
| A.棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味 |
| B.铁丝在氧气中燃烧火星四射,放出大量的热,同时生成黑色固体 |
| C.红磷在空气中燃烧,产生大量白雾 |
| D.把银片浸入硫酸铜溶液一段时间后取出,银片表面覆盖一层红色物质 |
下列化学方程式能正确表示所述内容的是
| A.盐酸除铁锈:Fe203+6HCl = 2FeCl3+3H20 |
| B.实验室制备H2:Cu+H2S04 = CuSO4+H2↑ |
| C.铁丝在氧气中燃烧:4Fe+302 = 2Fe203 |
| D.CO2通入CaCl2溶液中:C02+CaCl2+H20=CaC03 ↓ + 2HC1 |
下图是A、B、C三种物质的溶解度曲线,下列分析错误的是
A.50℃时,A物质的溶解度最大
B.升温可使C物质的不饱和溶液变成饱和溶液
C.50℃时的A、B、C三种物质的饱和溶液降温至20℃时,B物质溶液的溶质质量分数最大
D.50℃时,把90gA物质放入100g水中能得到190g溶液
下列推理正确的是
A.向某无色溶液中滴加酚酞无现象,则溶液一定呈中性
B.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.某化肥中加熟石灰研磨,未闻到氨臭气味,该化肥一定不是氮肥
D.某有机物燃烧生成C02和H20,该有机物中一定含有C、H两种元素
为除去下列物质中的杂质(括号内为杂质),选用的试剂和操作方法都正确的是
| 序号 |
物质 |
选用试剂 |
操作方法 |
| A |
CO2(CO) |
O2 |
点燃 |
| B |
KNO3固体(KOH) |
H2O、CuCl2 溶液 |
溶解、加适量CuCl2溶液,过滤、蒸发结晶 |
| C |
CuCl2溶液(NaCl) |
NaOH溶液、稀盐酸 |
加稍过量NaOH溶液、过滤、洗涤、向沉淀中加稀盐酸至沉淀恰好溶解 |
| D |
NaCl固体(MgCl2) |
H2O、NaOH溶液 |
溶解、加过量NaOH溶液、过滤、蒸发结晶 |
下列各组变化中,每一转化在一定条件下均能一步实现的是
① ② ③
| A.②③ | B.①② | C.①③ | D.①②③ |
—定量某Fe203样品(含有少量的Fe0、CuO),与100g9.8%的稀硫酸,恰好完全反应。该Fe2O3样品中氧元素的质量是
| A.0.8 g | B.1.6g | C.3.2 g | D.6.4 g |
下列说法正确的是
| A.表面有食盐水的钢铁制品露置在空气中更易生锈 |
| B.玻璃钢、钢筋混凝土、塑料都属于复合材料 |
| C.为了产生更多的氢气和氧气,电解水时在水中加入稀硫酸 |
| D.用石灰乳与硫酸铜溶液混合可配制防治植物病害的波尔多液 |
将少量生石灰加入盛有饱和石灰水的烧杯中,冷却到室温,烧杯底部出现白色固体。下列说法 错误如是
| A.反应发生的化学方程式为:Ca0+H20=Ca(0H)2 |
| B.白色固体的主要成分为:Ca(OH)2 |
| C.冷却到室温过程中Ca(0H)2溶液的溶质质量分数始终保持不变 |
| D.反应后,溶液里溶质Ca(0H)2的质量减小 |
向含有和Cu(N03)2和AgNO3的混合溶液中加入一定量的铁粉,并绘制参加反应的铁与溶液中溶质种类的关系图(如图)。下列说法正确的是
| A.当参加反应的铁的质量为m1时,溶质的种类、析出的金属单质种类均为3种 |
| B.当参加反应的铁的质量为m2时,加入盐酸,有白色沉淀生成 |
| C.当参加反应的铁的质量为m3时,溶质为Fe(N03)2 |
| D.当参加反应的铁的质量为m2时,加入稀盐酸,有气泡产生 |
下列各组溶液,不用其他试剂就不能鉴别出来的是
| A.NaCl、 (NH4)2SO4、 NH4Cl、Ba(0H)2 | B.NaOH、NaCl、稀HCl、FeCl3 |
| C.Na2SO4、K2CO3、 BaCl2、 稀HCl | D.Na2CO3、稀H2SO4、稀HCl、NaNO3 |
硝酸钾是一种重要的化工产品,工业上制备硝酸钾的流程图如下:
下列说法正确的是
| A.操作I、II、III、 IV都是过滤 |
| B.①中反应为:CaS04+2NH4HC03=CaC03↓+(NH4)2S04+H20+C02↑ |
| C.滤渣2可以循环利用 |
| D.反应④后需要热过滤的原因是加快过滤速率 |
(4分)用化学用语表示:
(1)镁元素 ; (2) 3个碳酸根离子 ;
(3) 2个水分子 ; (4)空气中供人呼吸的气体 ;
(6分)请从下列物质中选择适当的物质填空(填字母编号):
| A.干冰 | B.酒精 | C.硫酸 | D.活性炭 E.石灰石 F.维生素C |
(1)可用于人工降雨的是 ; (2)工业上用于金属除锈的 ;
(3)蔬菜中富含的营养物质 ;(4)可作冰箱除味剂的是 ;
(5)医疗上常用的消毒剂 ; (6)用于制造水泥、玻璃的矿石是 。
(2分)下图是我国的一个低碳生活环境保护宣传图片。
(1)低碳生活主要是指减少 气体的排放。
(2)请你提出一条低碳生活的合理化建议 。
(4分)玻璃棒的主要作用如下:
①引流 ②加快溶解 ③均勻受热 ④蘸取少量试剂。
请用序号填写下列操作中玻璃棒的作用(每个序号只填写一次)。
(1)过滤 ; (2)蒸发 ; (3)溶解 ; (4)测溶液pH 。
(2分)最近有科学家提出“绿色自由”构想:将空气吹入K2C03溶液生成KHC03,然后加热使KHC03分解出C02,再转化为有机物实施碳循环。根据以下流程回答。
(1)吸收池中主要发生K2C03+H20+C02=2KHC03,则分解池中反应的方程式为 ;
(2)在合成塔中若气体X是H2,反应生成甲醇(CH3OH)和水,该反应方程式 。
(9分)请结合下图回答问题: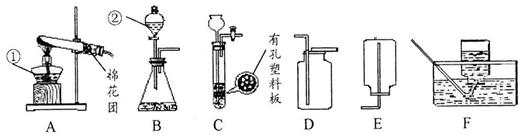
(1)写出图中有标号仪器的名称:① ,② 。
(2)用加热高锰酸钾的方法制取氧气,应选用的发生装置和收集装置是(填字母编号)
_ 和_ ,写出该反应化学方程式 。
(3)写出实验室用石灰石和稀盐酸制取CO2的反应化学方程式_ 。
(4)实验室用锌粒和稀硫酸反应制取氢气,常选用装置B或装置C,C与B相比较,其优点是 _ ,选用的收集装置为(填字母编号)_ 。
(5)下面是某同学设计的除去C0中的C02并收集一瓶C0的装置图(瓶内为NaOH浓溶液), 其中最合理的装置是_ 。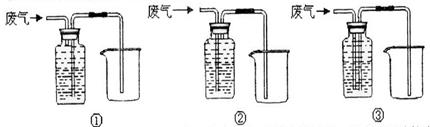
(7分)镁与NH4Cl溶液反应,不仅有一种盐生成,还有气泡产生。为确定气体的成分,进行下列实验探究。
(一)探究:气体可能是HCl、02、NH3、H2中的一种或几种。
(二)实验:
(1)甲同为确定是否含有HCl,他将气体通入酸化的硝酸银溶液中,无明显现象,则该气体中_ HCl (填“有”或“无”)。
(2)乙同学认为只有02,则可用_ 来检验。实验证明乙同学的观点不正确。
(3)丙同学为判断是否含有H2,同时确定气体成分,通过查阅资料得知:
2NH3+3CuO ="=" 3Cu+N2+3H20于是他设计了如下图实验装置:
(三)实验现象与结论:A中观察到_ ,证明有NH3; B中玻璃管内观察到_ ,证明有H2。
(四)实验反思:
(4)浓硫酸的作用是_ 。
(5)大家认为丙同学在加热之前,应对气体先_ 以确保安全。
(6)写出Mg与NH4Cl溶液反应的化学方程式 。
(5分)现有一包白色固体粉末,可能含有CuS04、Na2CO3、BaCl2、NaOH中的一种或几种。 现做如下实验:
(1)取少量白色固体加足量的水溶解,得无色溶液;
(2)向所得溶液中加入足量的氢氧化钙溶液,有白色沉淀产生,静置后向上层清液中滴加酚酞,溶液颜色变为红色。
根据上述实验现象判断:
白色固体中一定不含_ ,―定含有_ ,可能含有_ 。
若要判断可能成分是否含有,你认为应对步骤(2)做如何改进?_
写出(2)中产生白色沉淀的反应化学方程式__ 。
(6分)下图表示某些物质间转化关系。其中A、D是由相同元素组成的固体,且A为紫黑色,C、Z为黑色粉末,B、E、G为气体;X与F是由相同元素组成的无色液体,且X具有消毒杀菌作用;反应⑤常用来炼铁。请回答下列问题:
(1)A的化学式是_ ;
(2)C物质在反应2中的作用 ;
(3)写出反应②、④的化学方程式:
②_ ;④_ ;
(4)將E、G两种气体区别开来,可使用的一种溶液为_ (填名称);
(5)合成气CO和H2在一定条件下按照不同的比例可以合成不同的化工原料,达到原子利用 率最大的要求。以CO和H2合成的下列物质中,不符合要求的是_ 。
A.甲醇(CH4O) B.乙酸(C2H4O2) C.乙醇(C2H6O) D.甲醛(CH2O)
(15分)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。
一、铁红制备的流程图分析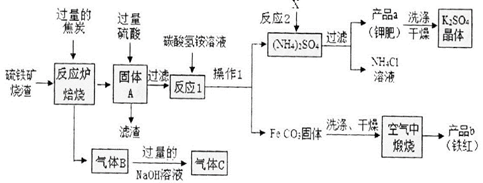
(1)写出焙烧中CO与Fe203反应的化学方程式_ 。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒 和_ (填仪器名称)
(3)你认为对气体C最佳的处理方法 是_ 。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是_ 。
(5)反应2中相关物质的溶解度如下表。你认为该反应在常温下能实现的原因是 。
洗涤干燥得到K2S04晶体时,可选用下列__ (填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入_ (选填序号,下同),
振荡、静置,再向上层清液中滴加_ ,观察现象即可判断。
A.AgN03溶液 B.过量的BaCl2溶液 C.过量的Ba(N03)2溶液
二、铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204·3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4·3H2O C02↑+C0↑+4H20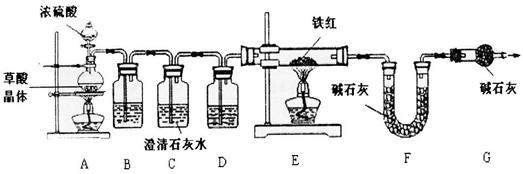
(6)实验前应先_ 。
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是__ 、___ (填字母编号)。
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
(8)C装置的作用是 。
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图。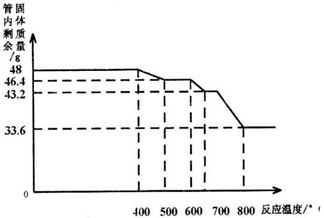
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁。
(9)800℃以上时,管内固体成分的化学式为 ;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式_ 。
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号