活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下: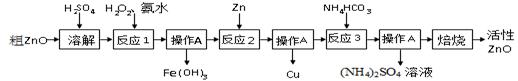
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 |
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3•yZn(OH)2•zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3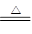 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2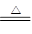 ZnO+H2O
ZnO+H2O
【实验步骤】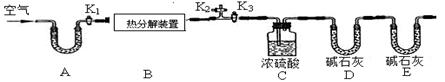
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
| |
装置C的质量(/g) |
装置D的质量(/g) |
| 实验前 |
198.4 |
235.7 |
| 实验后 |
209.2 |
244.5 |
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
化学与健康--从化学的视角看食品添加剂。
从化学的视角看食品添加剂,主要是从其元素组成与结构、物理化学性能及在人体内的变化等方面来研究。结合表中信息回答下列问题。
| 物质的组成与性能 |
用于食品添加剂 |
|||
| 物质名称 |
物质组成 |
主要化学性质及在体内变化 |
类别或作用 |
法律规定 |
| 碳酸氢钠 |
NaHCO3 |
无毒、弱碱性,易与胃酸反应,加热分解成碳酸钠、水和二氧化碳 |
膨松剂 |
可用 |
| 铁 (还原性铁粉) |
Fe |
比较活泼的金属,能与胃酸反应 |
抗氧化剂 |
依据国家标准可用 |
| 食盐 |
NaCl |
易溶、中性,与硝酸银溶液反应生成白色沉淀 |
调味剂 |
可用 |
| 甲醛 |
CH2O |
 |
防腐 |
国家严禁使用 |
| 亚硝酸钠 |
NaNO2 |
易溶、水溶液显碱性,跟硝酸银反应生成浅黄色沉淀 |
发色剂、防腐剂 |
严格依据国家标准 |
(1)国家严格禁止甲醛作为食品添加剂的原因是。
(2)还原性铁粉用于食品添加剂,除能够防止食品因氧化而变质外,还是一种营养强化剂,这是因为。
(3)碳酸氢钠是面食类食品经常使用的添加剂,如蒸馒头时人们常常加适量的碳酸氢钠,其作用是,写出发生反应的化学方程式。
(4)亚硝酸钠(
)外观酷似食盐,有咸味,常被误作食盐食用而导致中毒事件发生。有一包外观酷似食盐的固体,结合表中信息,如何鉴别它是亚硝酸钠还是氯化钠(包括选取的试剂、方法、实验现象和结论,只写出一种方法即可)。
(5)从改善食品的色香味、延长食品的保质期等方面,食品添加剂确实提高了现代食品的品质,但副作用也是显而易见的。我们需要食品添加剂吗?你的观点是。
“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是一种重要的铜矿石原料。小明欲从孔雀石中提炼出单质铜。
【查阅资料】(1) 碱式碳酸铜加热易分解,其方程式为:Cu2(OH)2CO3加热2CuO+CO2↑+H20。
(2) 向Cu2(OH)2CO3中加入足量的盐酸,固体完全溶解,有无色气体生成,写出此反应的化学方程式: 。
【设计方案】在实验室中以碱式碳酸铜、铁粉、稀盐酸为原料来制取单质铜。请你仿照下图画出方案二制取铜的流程图,要求:步骤最少。
方案一:
方案二:你设计的方案为
【进行实验】方案一中最后一步:在溶液中加入过量的Fe的实验现象为
【反思】铜锈的主要成分也是碱式碳酸铜,从碱式碳酸铜的化学式[Cu2(OH)2CO3]推知,铜生锈可能与空气中的氧气、水、________________________有关。
.海水是巨大的资源宝库。下图是综合利用海水制备的一些产品的流程:
(1)操作a 的名称是 ,在实验室中完成此项操作需要的玻璃仪器有烧杯、玻璃棒和 。
(2)步骤①中用蒸发结晶法而不采用降温结晶法的理由是 。
(3)步骤④应加入的物质是 。
(4)请写出步骤②、③发生反应的化学方程式:
② ,③ 。
一辆有约30吨硝酸的罐车在某厂道路发生侧翻,硝酸泄露,散发出黄色烟雾,流到石灰石地面,发出嘶嘶声,产生大量气泡,泄露出来的硝酸不断流进路边的排水沟,气味十分刺鼻.
(1)由题给信息可知,硝酸的物理性质是 _________ (任写一条)
(2)硝酸见光后,除分解生成二氧化氮气体外,还生成水及占空气体积分数约21%的气体,实验室保存硝酸应密封,遮光保存在棕色瓶内,放在低温阴凉处,硝酸见光分解的化学方程式为 _________
(3)为消除硝酸对环境的污染,对泄露的酸必须处理,经济上合理、对环境污染小的化学处理方法是 ________ .
我们学习化学的目的之一就是学会从化学的视角认识和分析生活生产中的一些问题。
(1)2013 年济南市整合趵突泉、大明湖、五龙潭、护城河等旅游资源,组建天下第一泉风景区,它集独特的自然山水景观和深厚的历史文化底蕴于一体,为 5A 级景区。
①对泉水的下列说法中明显错误的是 (填序号)
A.清澈的泉水是溶液 B.蒸馏是净化程度很高的净水方法
C.可用煮沸的方法降低泉水的硬度 D.过滤可以除去泉水中的可溶性杂质
②某化学小组的小泉同学取2滴非常清澈的趵突泉水滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是
。
③济南市区居民的大部分饮用水来自地表天然水,天然水转化成饮用水需经一系列净化,Cl2是一种廉价的自来水消毒剂,与水反应生成次氯酸(HClO)有较强的杀菌作用。氯气(Cl2)和次氯酸中氯元素的化合价分别是 。
(2)化学与食品安全、环境保护、人体健康等密切相关。下列说法错误的是 (填序号)
A.在食盐中添加适量碘酸钾,补充人体所需的碘元素
B.“低碳生活”倡导大量使用化石燃料,鼓励人们多开汽车出行
C.香烟的烟气中含有许多有毒物质,吸烟有害健康
2012年4月15日,央视《每周质量报告》对“非法厂商用皮革下脚料造药用胶囊”曝光,其制成的胶囊往往重金属铬超标。
(1)重金属的毒性主要是由于它与人体内酶的—SH基结合而产生。误食重金属盐后,可尽快喝适量牛奶或鸡蛋清解毒。牛奶和鸡蛋清富含的营养素是______________。
(2)下图是铬元素在周期表中的一格,你能从该图的数字得到的信息有:_____________(写一条)。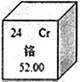
(3)铬是银白色有光泽且硬而脆的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。人们通常在自行车车圈、水龙头等表面镀一层铬,是为了_________。
(4)铬的化合物可用于检测是否酒后驾车,其原理为遇到酒精红色的CrO3转变为绿色的Cr2(SO4)3,在Cr2(SO4)3中铬元素的化合价为___________________。
实验室有一瓶无色溶液,标签模糊,依稀可见
.为探究该溶液中是否有硫酸根,化学兴趣小组的同学设计以下甲、乙方案,并取样品实验、记录相关现象.

请根据上述信息,完成下列问题:
(1)方案甲得出的结论是:不能确定无色溶液中是否含有硫酸根.理由是.
(2)方案乙得出的结论是:无色溶液中含有硫酸根.则加入足量稀
的作用是;如果加入稀
有气泡产生,则可能发生反应的化学方程式是。(写1个)
(3)另取无色溶液少许,滴入紫色石蕊试液,溶液变红.若溶液中只含有一种阳离子,则方案乙中产生白色沉淀的化学方程式为。
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: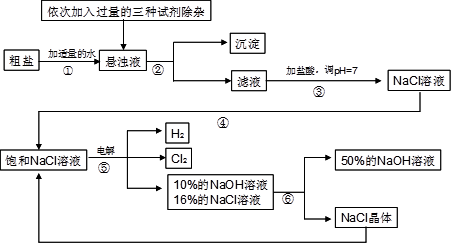
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,不正确的是 。
| A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
| C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
(2)操作②的名称是 ,该操作所需的玻璃仪器是 ;操作④的名称是 ,该操作需玻棒不断搅拌,这是为了防止 。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之 (填“前”或“后”)加入。有同学提出用 溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是 。
(5)该流程中可以循环利用的物质是 。
比较、分析、归纳是学习化学的重要方法。通过比较可以发现相同的反应物在不同外界条件下,会发生不同的反应。请参照示例归纳反应规律:
| 组别 |
化学方程式 |
规律 |
| 示例 |
 |
反应物相同时,反应物的量不同,生成物不同 |
| (1) |
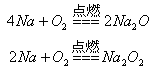 |
|
| (2) |
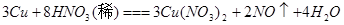  |
|
现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成。为确定其
组成,进行了如下图所示的实验[假设实验过程无损耗;碳酸钠溶液能与氢氧化钙反应,化
学方程式为:Na2CO3+Ca(OH)2→CaCO3↓+2NaOH]。
请用化学式回答:
(1)根据实验可以确定白色沉淀是 ;X溶液中一定含有的溶质是 ;
(2)原固体粉末中一定含有 ,它的可能组成有哪几
组 。
【10桂林30】 (6分) A、B、C、D、E是初中化学中的五种常见物质。C、D是单质,C为紫红色固体,D被认为是最清洁的能源。B的浓溶液常用做干燥剂。已知Fe和A、B的水溶液分别能发生反应:
①Fe + A → C + E; ②Fe + B → D + E 。
(1)写出A、B、C的化学式: A , B ,C 。
(2)现有Fe和A、C三种固体组成的混合物,小刚想测定该混合物中C物质的质量分数,他设计并完成了以下实验:
你认为,小刚的实验数据处理是否正确(填“正确”或“ 不正确”) ,理由是 。
(10湛江22).(8分)某学校化学兴趣小组用NaCl固体(含有的杂质CaO)来配制一定质量分数的NaCl溶液,实验的流程图如下: 
请回答:
(1)写出适量HCl加入到溶液B中所发生反应的化学方程式为__________________________。
(2)操作2的名称是__________,在溶液A中加入过量碳酸钠的目的是________________。
(3)若要配制100g质量分数为10%的氯化钠溶液,除了用到天平、烧杯、量筒外,还需用到的玻璃仪器是__________,其作用是______________________________。
(10芜湖12).某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。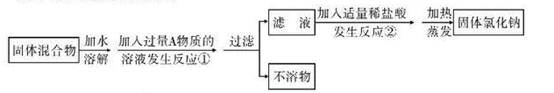
(1)写出A物质的化学式: ,写出A物质的俗称: 。
(2)写出反应②的化学方程式: 。
(3)反应①中加入过量A物质的目的是 。
反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度 (填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (填“增大”、“不变”或“减小”)。
某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2,小青同学设计了以下实验方案来除去可溶性杂质。 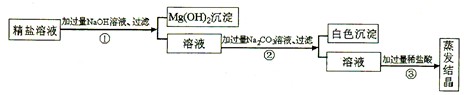
步骤①的化学方程式为_______________________________________。
步骤②中得到的白色沉淀是_________________________ (填化学式)
步骤③中加稀盐酸是为了除去溶液中的___________________。
| A.CaCl2 | B.MgCl2 | C.NaOH | D.Na2CO3 |