如图中A、B、C、D是四种粒子的结构示意图.请回答下列问题:
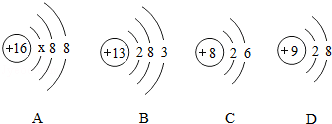
(1)A中x= ;A粒子的化学式是 .
(2)由B粒子的结构示意图可知,B粒子的名称是 .
(3)以上四种结构示意图所表示的粒子中,表示离子的是 (填字母代号).
元素周期表是学习和研究化学的重要工具.回答下列问题:
(1)元素周期表中不同元素间最本质的区别是 (填字母).
A.质子数不同 B.中子数不同 C.相对原子质量不同
(2)1869年, (填字母)发现了元素周期律并编制出元素周期表.
A.张青莲 B.门捷列夫 C.拉瓦锡
(3)元素周期表中氟元素的有关信息如图所示,下列说法正确的是 (填字母).
A.氟属于金属元素 B.氟的原子序数是9 C.氟的相对原子质量是19.00g
(4)氟原子结构示意图为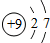 ,氟原子在化学反应中易 (填“得到”或“失去”)电子,由钠元素和氟元素组成的化合物氟化钠的化学式为 .
,氟原子在化学反应中易 (填“得到”或“失去”)电子,由钠元素和氟元素组成的化合物氟化钠的化学式为 .

氧气是一种化学性质比较活泼的气体.在铁丝在氧气中燃烧的实验,回答下列问题:
(1)铁丝在氧气中燃烧的现象是
(2)铁丝绕成螺旋状的目的是
(3)在集气瓶中铺上沙子和少量水的目的是
(4)反应的文字表达式为 .
已知一个质子数和中子数都是8的氧原子的质量为A千克,若以此原子质量的十六分之一作为相对原子质量的计算标准.则:
(1)一个质量为n千克的原子的相对原子质量是 (用含字母的式子表示,下同).
(2)若按此标准求的某原子的相对原子质量为56,则该原子的实际质量是 千克.
如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:

(1)用图中表示的序号表示配制溶液的正确操作顺序 .
(2)图②中,有一种塑料仪器,其名称是 .
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图⑥,则称取的NaCl质量为 .
(4)根据计算需要量取水的体积是 (水的密度为1g/mL).
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%.
如图中的①、②分别是钠元素、;氯元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图.
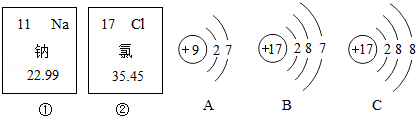
试回答下列问题:
(1)钠元素的原子序数为 ,画出它的原子结构示意图 ;
(2)A、B、C中属于同种元素的粒子是 ;
(3)A和B两种粒子的 相同,所以它们具有相似的化学性质;
(4)钠原子和氯原子反应所形成的化合物是由 (填“分子”、“原子”、“离子”)构成的.
将生锈的铁钉放入过量的盐酸中,首先看到铁锈溶解,溶液呈 色,这是因为(用化学方程式表示) ,不一会儿,又看到溶液中有 的现象,这是因为(用化学方程式表示) .
在用白磷探究质量守恒定律的实验中,同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示.请回答下列问题: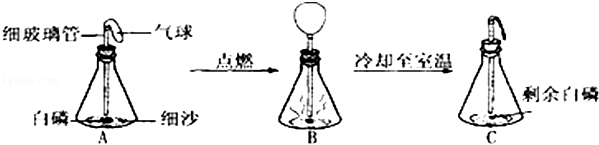
(1)图中瓶底铺细沙的作用是: .
(2)白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论是质量不守恒.待锥形瓶冷却后,重新放到托盘天平上称量,天平保持平衡.结论是:质量守恒.你认为结论正确的是 ( 填“前一种”或“后一种”).而导致另一种结论错误的原因是 ..
(3)实验观察到A、C中气球的大小不同,用理化知识解释产生此现象的原因是:
(4)由质量守恒定律可知,化学反应前后,一定不变的是 .(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.
在生活中重金属盐类也可作为消毒杀菌的药物来使用,如图所示为硝酸银滴眼液药品说明书的一部分.从其贮藏条件“遮光”可以看出,硝酸银溶液具有 的化学性质.“滴眼后用0.9%的生理盐水冲洗”来减轻硝酸银对眼睛的腐蚀性,应用的科学原理是: (用化学方程式表示).

对知识的归纳和总结是学好化学的重要方法.在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应.

(1)为了检验反应③能够发生,你可选择下列哪些物质?
A HCl B FeCl3 C CaO D KOH E Na2CO3
(2)农业上常用氢氧化钙来改良酸性土壤,是利用其化学性质中的 (填序号).
某同学选择“金属和酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用接触面积、质量相同的金属丝和足量稀酸反应的三组实验数据:
| 实验编号 |
反应物 |
酸的质量分数% |
反应的温度℃ |
金属丝消失的时间s |
| ① |
铝丝和稀盐酸 |
5 |
20 |
450 |
| ② |
铝丝和稀盐酸 |
10 |
20 |
240 |
| ③ |
铝丝和稀盐酸 |
10 |
30 |
65 |
| ④ |
铁丝和稀盐酸 |
10 |
30 |
125 |
| ⑤ |
铝丝和稀硫酸 |
10 |
30 |
超过1000 |
(1)实验开始前都需要用砂纸充分打磨金属,目的是:
(2)对比试验 可知,金属和酸反应的快慢还与金属的种类有关.
(3)本通过测量 来反应金属和酸反应的快慢.
(4)通过比较实验①和②可得出实验结论: .
请根据下表回答有关问题
(1)写出纯碱的化学式 ;
(2)表中物质属于氧化物的是: ;属于盐的是: ;
| 序号 |
① |
② |
③ |
④ |
| 物质 |
醋酸 |
生石灰 |
熟石灰 |
纯碱 |
| 化学式 |
CH3COOH |
CaO |
Ca(OH)2 |
Na2CO3 |
(3)上述四种物质放入相等的水中,所得的溶液中pH最小的是 ;
(4)CH3COOH(其性质类似于盐酸)可以与表中 物质发生化学反应.
小明同学为探究“Na2CO3溶液与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如下表:
| 试剂1 |
试剂2 |
混合前温度/℃ |
混合后温度/℃ |
|
| 35毫升稀盐酸 |
25毫升Na2CO3溶液 |
20.0 |
第1次 |
24.2 |
| |
|
|
第2次 |
24.0 |
| 第3次 |
24.4 |
请你帮助填写相关内容:
(1)写出该实验涉及的化学反应方程式 ;
(2)该实验中所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是:
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是 (选填:“放热“或“吸热“)
小明家是种植蔬菜的专业户,他学习了初三科学后告诉父母:施用适量的氮肥可以使种植的蔬菜叶色浓绿.因此,
(1)他建议其父母去买的氮肥的是 .(填字母)
A.碳酸氢铵[NH4HCO3] B.硫酸钾[K2SO4] C.磷矿粉[Ca3(PO4)2]
(2)他还告戒父母在施用氮肥的同时 (填“能”或“不能”)施用草木灰(草木灰溶于水会电离出OH﹣).
“我爱生活,我爱化学”,城市居民生活所需净水,主要靠自来水厂供给。某化学兴趣小组的同学决定模拟自来水厂的净水过程,将绥江河受污染的河水(主要含有泥沙、悬浮物和细菌等杂质)最终制成蒸馏水。其净水流程如图所示:

请回答下列实验问题:
(1)图中若加入的A物质是明矾,则其作用是 ;
为除去水中的固体沉积物和一些难溶性垃圾,进行了实验操作Ⅰ,则操作Ⅰ的名称是 。
(2)我国生活饮用水的标准:
| 感官指标 |
化学指标 |
细菌学指标 |
| 水质无色无味且澄清透明 |
pH: 6.5~8.5;总硬度<250 mg/L(以碳酸钙计);铜< 1.0 mg/L……等 |
细菌总数<100个/mL等 |
自来水厂净水流程图中属于“细菌学指标”的液体是 。
①液体B ②液体C ③液体D
(3)取流程中进入用户的水于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明此饮用水是 (选填“硬水”或“软水”)。长期饮用硬水对人体健康不利,要降低水的硬度,可采用____________方法。
(4)流程中,在液体C中加入氯气的目的是 ,液体D通过操作Ⅱ得到蒸馏水,则操作Ⅱ的名称是 。
(5)水体污染的来源主要有工业污染、农业污染、 。
(6)为了防止水的污染,下列各项措施中可以采用的是 。
①抑制水中所有动植物的生长②不任意排放工业废水③禁止使用农药和化肥④生活污水经过净化处理后再排放
A.①② B.②③ C.①④ D.②④
(7)电解一定量的水,当其中一个电极产生5 mL气体时,另一电极产生的气体体积可能是 mL或 mL。