实验室为了测定过氧化氢溶液的质量分数,称取85.00g H2O2溶液和2.00g MnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
时间/S |
15 |
30 |
45 |
60 |
75 |
90 |
烧杯总质量/g |
136.5 |
136.1 |
135.70 |
135.50 |
135.40 |
135.40 |
(1)产生O2的质量为 g。
(2)过氧化氢溶液中溶质的质量分数为?(写出计算过程)
随着人类现代化程度迅速提高,温室气体(CO2)排放日益增加,为降低温室气体含量,科学家正在研究一种新型的“人造树叶”。假设每1升“人造树叶”每天可从空气中吸收二氧化碳880g并转化为乙醇(C2H5OH),对应化学方程式为2CO2+3H2O C2H5OH+3O2.请回答:
(1)写出该研究的一点意义 。
(2)若每天一棵树平均可吸收44g CO2,则一升“人造树叶”一天吸收的CO2相当于 棵树吸收的CO2。
(3)1升“人造树叶”工作一个月(按30天计)可得到乙醇多少克?(写出计算过程)。
取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。

菱镁矿中主要含MgCO3、FeCO3和SiO2.以菱镁矿为原料制取镁的工艺流程如图。
回答下列问题:
(1)菱镁矿属于 (选填“纯净物”或“混合物”)。
(2)流程中滤渣a主要成分是 。
(3)写出菱镁矿中MgCO3与稀HCl反应的化学方程式 。
(4)溶液b→溶液c反应的化学方程式为:4FeCl2+ +4HCl=4FeCl3+2H2O(补充完方程式)
(5)溶液c调pH使Fe3+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8﹣ 。
已知:物质沉淀的pH见下表:
物质 |
Mg(OH)2 |
Fe(OH)3 |
开始沉淀的pH |
8.9 |
1.5 |
完全沉淀的pH |
10.9 |
2.8 |
(6)结合流程中的数据计算。
①菱铁矿中镁元素的质量分数为 (不考虑整个流程转化中的损失)。
②MgCl2通电制得的气体的质量(写出计算过程)。
小嘉发现:向碳酸钠溶液中倾倒稀盐酸,很快就产生了气泡:向碳酸钠溶液中逐滴加入稀盐酸,滴加一定量后才有气泡产生。查阅资料:向碳酸钠溶液中逐滴加入稀盐酸,先发生的反应是Na2CO3+HCl═NaCl+NaHCO3;当Na2CO3全部转化成NaHCO3后,再发生反应NaHCO3+HCl═NaCl+H2O+CO2↑。为此他用如图所示装置进行了如下实验:
步骤一:在广口瓶中加入10克溶质质量分数为10.6%的碳酸钠溶液,用注射器向瓶中缓慢注入一定量的溶质质量分数为7.3%的稀盐酸,观察到瓶内无明显现象; 步骤二:继续用注射器向瓶中注入稀盐酸,一段时间后观察到瓶内连续产生气泡,烧杯中澄清石灰水?。 |
(1)步骤二中,观察到烧杯中澄清石灰水 。
(2)上述实验中,加入稀盐酸多少克后,才开始产生二氧化碳? 。
(3)向一定量碳酸钠溶液中无论是倾倒还是逐滴加入足量的稀盐酸,完全反应后产生二氧化碳质量是相同的,其本质原因是什么? 。

向一定量的澄清石灰水中通入适量的二氧化碳,使氢氧化钙全部转化为碳酸钙沉淀,得到的沉淀质量为1.00g。计算澄清石灰水中氢氧化钙的质量(计算结果精确至0.01g)。
某兴趣小组取CaCO 3和CaCl 2的固体混合物7.5g,加入到盛有一定质量某浓度稀盐酸的烧杯中,恰好完全反应,气体全部逸出后,所得不饱和溶液的质量为41.8g。
烧杯及烧杯内物质质量随反应时间变化如表。
| 反应时间 |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯及烧杯内物质质量 |
64 |
62.9 |
61.8 |
61.8 |
计算:
(1)生成CO 2的质量为 g。
(2)烧杯中原有稀盐酸的溶质质量分数是多少?
农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算讨程)。
欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答下列问题:
(1)反应中二氧化锰的作用是 。
(2)计算过氧化氢溶液中溶质的质量分数。(写出计算过程)

某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
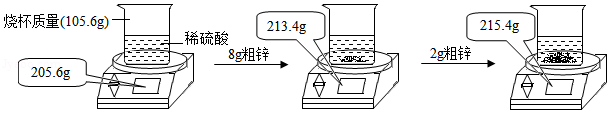
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
现有含氯化钠杂质的碳酸钠样品,取6.95g样品溶于水,配制成52.2g溶液。此溶液与50g某溶质质量分数的盐酸恰好完全反应,得到100g溶液。请分析计算:
(1)生成二氧化碳的质量是 。
(2)所得溶液中溶质的质量分数(写出计算过程)。
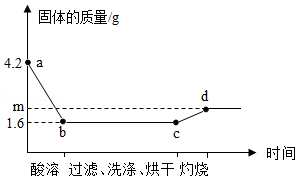
取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。(1)b点时溶液中溶质的化学式为 。
(2)原粉状混合物中铁粉的质量为 g。
(3)求m的值。(写出计算过程)
有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1 克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为 。
(2)这包白色粉末的成分为 。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)