锌粉、铝粉、镁粉的混合物3.8g与一定量的稀硫酸恰好完全反应生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸镁的混合物的质量为
| A.13.6g | B.13.4 g | C.12 g | D.11g |
某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )
| A.Zn和Fe | B.Cu和Au | C.Zn和Cu | D.Mg和Al |
下列图像不能正确反映其对应变化关系的是()
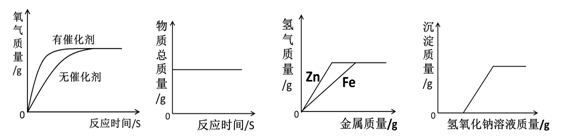
A B C D
| A. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 |
| B. | 一定质量的红磷在密闭容器中燃烧 |
| C. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 |
| D. | 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
有一包“铁”的粉末,可能含有Fe 、Fe2O3Fe3O4中的一种或几种,现称取23.2g放在试管中,通入足量的一氧化碳并加热充分反应,将生成的气体全部通入足量的澄清石灰水,共得到40g的碳酸钙固体。关于这包“铁” 的粉末成分判断正确的是
| A.一定是纯净物 | B.一定有Fe 、Fe2O3Fe3O4三种 |
| C.如果有Fe ,就一定有Fe2O3 | D.如果有Fe2O3,就一定有Fe3O4 |
有CO、CO2和N2的混合气体120g,其中碳元素的质量分数为20%.使该混合气体与足量的灼热氧化铁完全反应,再将气体通入过量的澄清石灰水中,充分反应后得到白色沉淀的质量为
| A.50 g | B.100 g | C.150 g | D.200 g |
金属氧化物陶瓷着色,有时测定金属氧化物中的金属含量。现将Fe2O3、CuO、Al2O3的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是
| A.20% | B.70% | C.73.5% | D.80% |
在天平两边的烧杯中分别100g、10%的稀盐酸,然后在左盘烧杯中加入10g碳酸钙,在右盘的烧杯中加10g的混合物,待烧杯中固体物质完全消失后,天平指针保持平,则该混合物可能是
| A.碳酸钠和碳酸钙 | B.碳酸氢钠和碳酸镁 |
| C.碳酸氢钾和碳酸钠 | D.碳酸氢钠和碳酸钠 |
在5.6g铁粉中,先逐滴加入一定量的Cu(NO 3) 2溶液,充分反应后再逐滴加入AgNO 3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
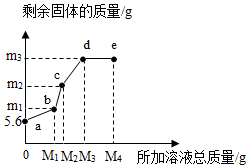
| A. |
所加溶液质量为M 1g时,生成Cu的质量为m 1g |
| B. |
bc段发生的是Cu和AgNO 3溶液的反应 |
| C. |
m 3的值为21.6 |
| D. |
e点溶液中不含Cu(NO 3) 2 |
烧杯中盛有锌粉和铁粉的混合物mg,向其中逐渐加入一定浓度的稀盐酸,测得剩余固体的质量与加入稀盐酸的体积的关系如图所示。下列有关结论正确的是( )
①加入V1mL稀盐酸时,剩余固体中不含锌
②加入V2mL稀盐酸时,溶液中的溶质为FeCl3和ZnCl2
③整个过程中发生反应均为置换反应
④反应中产生氢气的质量一定小于 g
g
⑤剩余固体质量m、n与稀盐酸的体积V1、V2的数量关系为 =
=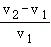

A.①②③④B.①③④C.①③⑤D.①③④⑤
下列图像与对应的叙述,相符合的是( )
A.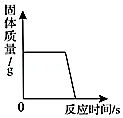 高温煅烧石灰石
高温煅烧石灰石
B. 氢气和氧气在密闭容器中燃烧
氢气和氧气在密闭容器中燃烧
C.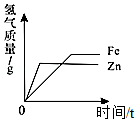 向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
D. 在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
已知一包铁粉中含有两种杂质,小明同学取5.6g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5g氢气。则该样品中的杂质可能是( )
A.Mg和ZnB.Al和ZnC.Zn和CuD.Mg和Cu
为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表
| 物质 |
丙烷 |
氧气 |
水 |
二氧化碳 |
X |
| 反应前质量/g |
4.4 |
12.8 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
4.4 |
a |
下列判断正确的是
A.X可能含有氢元素 B.X可能是该反应的催化剂
C.表中a的值为5.6 D.X只含碳元素
一定质量的木炭在氧气和氮气的混合气体的密闭容器中燃烧产生CO和CO2,且反应后测得混合气体中碳元素的质量分数为24%,则其中氮气的质量分数不可能为
| A.10% | B.20% | C.30% | D.40% |
如图所示四个图像对应的变化过程正确的是( )
A. 气体物质的溶解度与温度和压强的关系
气体物质的溶解度与温度和压强的关系
B. 浓硫酸长时间露置于空气中
浓硫酸长时间露置于空气中
C.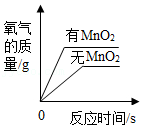 用等质量、等浓度的过氧化氢溶液分别制取氧气
用等质量、等浓度的过氧化氢溶液分别制取氧气
D.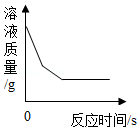 向足量的硫酸铜溶液中加入铁和镁固体混合物
向足量的硫酸铜溶液中加入铁和镁固体混合物