为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
宇航员在太空舱中,往往可利用自己呼出的二氧化碳与过氧化钠粉末作用来获得所需的氧气,(反应方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2)。假如某宇航员在某次太空飞行中预计消耗氧气480kg,请计算该宇航员在太空舱中至少应准备的过氧化钠的质量。(请写出计算过程)
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。请回答下列问题:
(1)二氧化锰在反应中的作用是__________________。
(2)计算该过氧化氢溶液中溶质的质量分数。
(3)利用上述溶液配制100g溶质质量分数为3%的过氧化氢消毒液,需该溶液的质量为__________g(结果保留一位小数)。
造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,工作人员取了40g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,测定铜的质量分数。图中铁架台等装置已略去。请回答下列问题: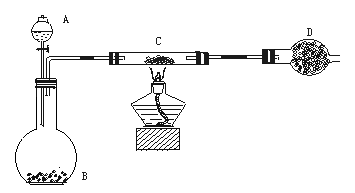
仪器:铁架台(含铁圈、铁夹)、分液漏斗、平底烧瓶、硬质玻璃管、干燥管、酒精灯、石棉网、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物,可用来吸收水和CO2)。
(1)除上述仪器外,实验中还必须用到的仪器是 ;
(2)实验操作前,首先进行 检查。在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。打开A的上塞、活塞,慢慢滴加溶液。对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。冷却后,称量D的质量为m2 g。 实验进行的过程中,装置C中发生的主要化学反应类型 ;充分反应后装置C中剩余的固体成分是 。
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,该装置作用是 。
(4)有学生提出直接用右图装置,在空气中直接加热进行实验。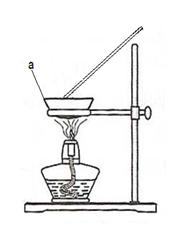
图中仪器“a”的名称为 。
若取20g铜粉(含炭)样品进行实验,充分反应后,仪器a中剩余的固体质量为24g,计算求原来混合物中铜的物质的量以及铜的质量分数。
(要求:根据化学方程式计算,并写出计算过程!)
为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| |
反应前 |
反应后 |
|
| 实验 数据 |
生理盐水样品的质量 |
加入硝酸银溶液的质量 |
过滤后剩余溶液的质量 |
| 130 g |
40 g |
167.13 g |
(1)反应后生成氯化银固体的质量为 g。
(2)请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算) 。
(3) 。
下面是工厂苛化法生产烧碱的示意图。
(1)在实验室,操作Ⅰ的名称是 ;经操作Ⅰ得到废渣的主要成份是 (写化学式)。
(2)物质X中各元素的质量比表示为 。
(3)某工厂化验员向含有1.6 g氢氧化钠的溶液中,逐滴加入20.0 g盐酸至氢氧化钠和盐酸恰好完全反应。求盐酸中溶质的质量分数为多少?(写出过程)
(4)若用1.6 g上述得到的固体烧碱产品(含杂质)代替1.6 g氢氧化钠,逐滴加入上述相同浓度盐酸至反应物恰好完全反应,则消耗盐酸的质量 20 g(填“大于”、“等于”或“小于”)。
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量为 ;B点对应溶液中所含的溶质有 。
(2)试样中碳酸钠的质量分数(结果精确到0.1%);
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
(3)由此得到启示是:在使用黄铜制品时应注意 。(合理即可)
已知金属钠和水能发生下列反应:
2Na+2H2O=2NaOH+H2↑,现将一定质量的金属钠放入75.6克水中,反应后生成8克氢氧化钠,计算:
(1)参加反应的水是多少克?
(2)反应后得到的氢氧化钠溶液中溶质的质量分数是多少?
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究。
【查阅资料】 Ⅰ.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
Ⅱ.碳酸钠溶液呈碱性。
【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示。
(1)加热一段时间后,观察到烧杯内壁有__________。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:___________________。
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3。
①他们的依据是____________________________________。
②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写下表:
| 实验 |
实验现象 |
结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 |
溶液变成红色 |
固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 |
_____________ |
固体产物是Na2CO3,而不是NaOH |
| 实验三:___________________ ___________________________ |
产生大量气泡 |
固体产物是Na2CO3,而不是NaOH |
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时兴趣小组的同学认为方案一的结论不正确,他们的理由是_____________________________________________。
【总结】请写出碳酸氢钠受热分解的化学方程式________________________。
(4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0 g逐滴加入稀盐酸,所得气体的质量为4.4 g。求:样品中碳酸氢钠的质量分数。
某工厂需要280g生石灰(CaO)作干燥剂,需要碳酸钙的质量是多少?至少需要含碳酸钙80%的石灰石(杂质不参加反应)的质量是多少?(CaCO3 CaO+CO2↑)
CaO+CO2↑)
将24.1 g由NaCl和BaCl2组成的固体混合物溶解于99.2 mL水 中(ρ水 ="1" g/ cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。 所加Na2SO4溶液质量与生成沉淀质量的关系如图,计算:
(1)生成沉淀的质量是多少?
(2)反应后所得溶液中溶质的质量分数为多少?
下图是胃得乐牌胃药的部分标识。胃药中所含的物质能中和胃里过多的胃酸(主要是盐酸)。某患者按标识上的服用方法服药三天后病情好转。计算患者在三天内所服用的此胃药中(计算结果取整数):
| 胃得乐牌 功能:主治胃酸过多引起的胃病 成分:每片含氢氧化镁250 mg 服用方法:每日三次,每次2片 |
(1)所含氢氧化镁的质量为____________ mg。
(2)理论上可中和胃酸中的HCl的质量为____________ mg。
小明同学将 13.9g 含杂质的的纯碱样品(碳酸钠与氯化钠的混合物)与 90.5g 稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
| 反应时间t/s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 气体质量m/g |
0 |
0.88 |
1.76 |
2.64 |
3.52 |
4.4 |
4.4 |
根据题目要求,回答下列问题:
(1)碳酸钠完全反应后,生成 CO2的质量为 。
(2)求完全反应后所得溶液中溶质的质量分数。