中考化学专项练习 第九单元 溶液
以下关于溶液的叙述,正确的是( )
| A.溶液是均一、稳定的混合物 |
| B.溶液是均一、透明的无色液体 |
| C.正在配制的蔗糖溶液下面更甜,说明溶液中总是下面更浓 |
| D.糖水是溶液,所以糖水放再长时间,蔗糖也不会分离出来 |
下列有关溶液性质的说法错误的是( )
| A.煮沸的咸汤比煮沸的水温度高 |
| B.溶液一定是无色透明的 |
| C.食盐水能导电是因为食盐水中含有较多自由移动的离子 |
| D.海水是盐溶液,所以冬天海水不易结冰 |
衣服上沾有碘很难洗净。由下表分析,在家除去碘污渍最好选用( )
| 溶质 |
溶剂 |
|||
| 水 |
酒精 |
苯(一种有机溶剂,有毒) |
汽油 |
|
| 碘 |
微溶 |
可溶 |
易溶 |
易溶 |
A.水 B.苯 C.汽油 D.碘酒
下列哪种方法洗涤餐具效果更好( )
| A.冷水 |
| B.热水 |
| C.在冷水中加入几滴洗涤剂 |
| D.在热水中加入几滴洗涤剂 |
下列清洗方法中,利用乳化作用的是( )
| A.用自来水洗手 |
| B.用汽油清洗油污 |
| C.用洗涤剂清洗油腻的餐具 |
| D.用盐酸清除铁锈 |
下列关于生理盐水的说法中,错误的是( )
| A.生理盐水的溶剂是水 |
| B.各部分一样咸体现了溶液成份的均一性 |
| C.饮用生理盐水可以为人体补充无机盐 |
| D.水分子是保持NaCl性质的最小微粒 |
在化学课上,老师做了一个趣味实验,在下面的装置中,用胶头滴管向瓶中的固体滴加一种液体,立即看到红色的小气球鼓起来。同学们纷纷猜测瓶内的固体和滴加的液体是什么,下面猜测可能正确的是( )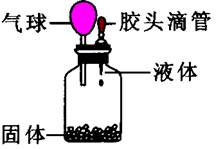
①锌和稀硫酸;②石灰石和盐酸;③氯化钠和水;④氢氧化钠和水;⑤硝酸铵和水
| A.①②③⑤ | B.①②④ | C.①②③⑤ | D.①③④⑤ |
下列关于溶解度的说法正确的是 ( )
| A.在温度不变时,溶剂量越多,溶质的溶解度越大 |
| B.20℃时,100 g氯化钠饱和溶液中溶解了26.5 g氯化钠,则20℃时氯化钠的溶解度为26.5 g |
| C.搅拌可以使固体物质的溶解度增大 |
| D.20℃时将31.6 g硝酸钾放入100 g水中,形成硝酸钾的饱和溶液,20℃时,硝酸钾的溶解度为31.6 g |
一杯20℃的NaNO3溶液,能证明它是饱和溶液的是( )
| A.蒸发10g水有NaNO3晶体析出 |
| B.降低10℃时,有NaNO3晶体析出 |
| C.加入10g NaNO3晶体,仍有NaNO3晶体未溶解 |
| D.在该温度下,加入少许NaNO3晶体,晶体质量不减少 |
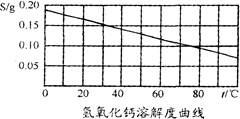
根据下图熟石灰的溶解度曲线,以下说法正确的是( )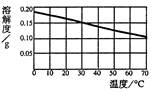
| A.熟石灰的溶解度为0.165g |
| B.熟石灰的溶解度随温度升高而增大 |
| C.熟石灰的饱和溶液降温时会析出晶体 |
| D.20℃时,100g水中加入1g熟石灰,搅拌,得到饱和溶液 |
如图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是( )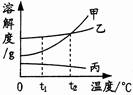
| A.在t1℃时,三种物质的溶解度由大到小的顺序是甲>乙>丙 |
| B.在t2℃时,甲、乙两物质的溶解度相等 |
| C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液 |
| D.当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙 |
将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发)。下图中四位同学对变化后溶液的分析错误的是( )

如图为A、B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是( )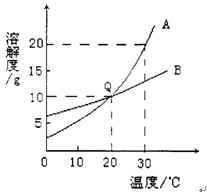
A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少
D.等质量的A和B的饱和溶液从30℃降到20℃时,B析出的晶体最多
根据下列几种物质溶解度曲线图,得到的结论正确的是( )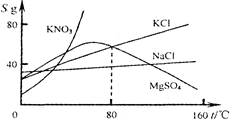
| A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯 |
| B.氢氧化钙饱和溶液降低温度后有晶体析出 |
| C.80℃时,氯化钾与硫酸镁的溶解度相等 |
| D.所有物质的溶解度均随温度的升高而增大或随温度的降低而减小 |
请根据下列实验和溶解度曲线回答问题: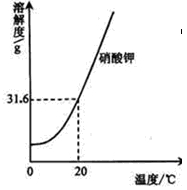
(已知水的密度约为1g/cm3)
| 实验操作 |
实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20℃ |
全部溶解,得溶液① |
| 再加wg硝酸钾,搅拌,恢复至20℃ |
恰好饱和,得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20℃ |
得溶液③ |
| 加热 |
全部溶解,得溶液④ |
| 冷却至20℃ |
析出晶体,得溶液⑤ |
(1)③中溶液的质量为 g;一定属于不饱和溶液的是(填序号,下同)
(2)析出晶体的质量为 。
A.25g B.(w+25)g C.(w+50)g
下表是3种物质在不同温度时的溶解度,根据表格信息答题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
| Ca(OH)2 |
0.18 |
0.16 |
0.14 |
0.12 |
0.09 |
0.07 |
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式)。
(2)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g(保留小数点后一位)。
(3)某KNO3晶体中有少量NaCl、Ca(OH)2杂质,要得到纯净KNO3的方法是:先加热溶解,然后 ,过滤、洗涤、干燥后得到KNO3晶体。
用氯化钠固体配制一定质量分数的氯化钠溶液,不需要用到的仪器是 ( )
| A.烧杯 | B.量筒 | C.托盘天平 | D.蒸发皿 |
用氯化钠配制100 g溶质质量分数为0.9%的生理盐水,现有下列操作:①配制溶液;②称取氯化钠固体;③过滤;④量取蒸馏水;⑤计算。正确的操作顺序是( )
| A.①②③④ | B.⑤②④① | C.⑤①②④ | D.③②④① |
海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
| A.溶质质量增加 | B.溶液质量不变 |
| C.溶剂质量减少 | D.溶质质量分数不变 |
向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )

| A.②中A的质量分数最大 |
| B.③⑤中A的质量分数相等 |
| C.②④⑤的溶液为饱和溶液 |
| D.①③④⑤中没有固体存在 |
t1℃ 时,分别将20g甲、乙两种晶体(不含结晶水)加入盛有100g水的两个烧杯中,恰好完全溶解,升温到t2℃时出现甲、乙烧杯中所示的现象。根据上述实验,结合下图中甲、乙两物质的溶解度曲线,判断下列说法正确的是( ) 

| A.t1℃时烧杯中甲、乙两物质形成的溶液是不饱和溶液 |
| B.t1℃时烧杯中甲、乙两物质形成的溶液溶质质量分数约为16.7% |
| C.t2℃时烧杯中甲物质溶液的质量是110g |
| D.t2℃时乙物质的溶解度是30g |
如图是A、B两种固体物质的溶解度曲线,下列说法正确的是
A.A的溶解度都大于B的溶解度
B.t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大
C.t2℃时,A、B两种饱和溶液中,溶质的质量分数相等
D.A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等量
在某温度下,NaCl 的溶解度为36g,求:
(1)在此温度下200g水最多可溶解 克NaCl
(2)2010g此温度下的饱和溶液里溶质的质量分数为 %(精确到0.1%)
下图是小明配制100g溶质质量分数为12%的NaCl溶液的有关实验操作示意图。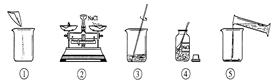
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、________、_________、量筒。
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果。________________________________________。
(3)图②、图③表示的操作步骤分别是________________。
(4)配制时需称量氯化钠____________g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会________________(填“偏大”或“偏小”);量取水最好选择______________的量筒(填序号①10mL②50mL③100mL)。(水的密度为1g/cm3)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号