“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
我国早在春秋战国时期,就开始生产和使用铁器。某化学小组到钢铁厂做社会调查,将不同质量的生铁样品(假定其中只含铁和碳两种单质)分别放入5只烧杯中,各加入189.2 g质量分数相同的稀硫酸进行实验,实验数据见下表:
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入生铁样品 的质量/g |
3.0 |
6.0 |
9.0 |
12.4 |
14.0 |
| 充分反应后 生成气体 的质量/g |
0.1 |
M |
0.3 |
0.4 |
0.4 |
试计算:
(1)表中M的值为________。
(2)烧杯④中完全反应后,所得溶液中溶质的质量是多少?(写出计算过程)
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;

实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母)。

Ⅲ制备还原铁粉
制备还原铁粉的工业流程如下:

(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22gCO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:

SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是 ,干燥的SAP材料作用是 。
根据如图所示信息计算:
(1)加入的稀硫酸质量为 g。
(2)所用稀硫酸溶质的质量分数。(化学方程式:2KOH+H2SO4=K2SO4+2H2O)
实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
实验序号 |
所取样品质量(g) |
所加盐酸质量(g) |
生成氢气质量(g) |
Ⅰ |
16.0 |
60.0 |
0.5 |
Ⅱ |
16.0 |
130.0 |
1.0 |
Ⅲ |
16.0 |
150.0 |
1.0 |
镁粉样品中金属镁的质量百分含量为 。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)

某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
烧杯中盛有锌粉和铁粉的混合物mg,向其中逐渐加入一定浓度的稀盐酸,测得剩余固体的质量与加入稀盐酸的体积的关系如图所示。下列有关结论正确的是( )
①加入V1mL稀盐酸时,剩余固体中不含锌
②加入V2mL稀盐酸时,溶液中的溶质为FeCl3和ZnCl2
③整个过程中发生反应均为置换反应
④反应中产生氢气的质量一定小于 g
g
⑤剩余固体质量m、n与稀盐酸的体积V1、V2的数量关系为 =
=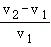

A.①②③④B.①③④C.①③⑤D.①③④⑤
钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。

提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc═CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是 。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是 (选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明 。
用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
加入CaCl2溶液的质量/g |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
反应后溶液的总质量/g |
118.0 |
136.0 |
154.0 |
M |
191.0 |
211.0 |
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
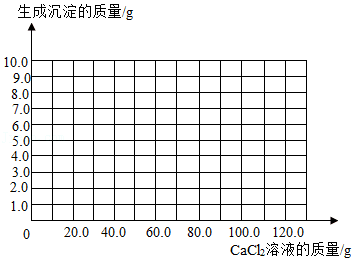
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

工业上制作电路的一种反应原理是Cu+2HCl+H2O2 CuCl2+2H2O.若反应了6.4g Cu,计算需要10%的H2O2溶液的质量。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
(3)在一烧杯中盛有Mg(OH)2和MgCl2的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).

某Na 2CO 3样品中混有一定量的Na 2SO 4,小明想测定样品中Na 2CO 3的质量分数,取该样品20克放入烧杯,加入100克水使样品全部溶解,再向烧杯中滴加稀硫酸,当滴加的稀硫酸质量为50克时,恰好完全反应,称得烧杯中溶液的质量是165.6克.
请通过计算回答:
(1)滴加的稀硫酸中溶质的质量分数.
(2)该样品中Na 2CO 3的质量分数.
部分被氧化的铁片10g与200g的稀硫酸恰好完全反应,产生氢气0.3g,求该硫酸溶液的溶质质量分数?