有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量m 1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m 2。
Ⅲ.实验数据如下表:
| 反应前总质量m 1 |
反应后总质量m 2 |
| 371.84g |
371.24g |
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H 2O  NaAlO 2+3H 2↑
NaAlO 2+3H 2↑
(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有 。
A.向锥形瓶中倒入样品时,撒出了部分粉末
B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量

为了区别氢氧化钠和氢氧化钙溶液,甲同学设计了如下图所示的四组实验方案。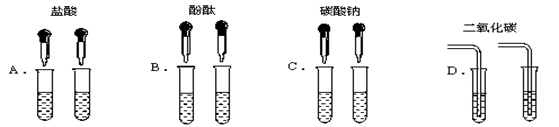
(1)其中能达到实验目的的是
(2)实验结束,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色。
(3)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物。
(4)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
| 实验内容 |
预测现象 |
结论 |
| 取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 |
①若有白色沉淀,溶液呈无色 |
物质是碳酸钠 |
| ②若无沉淀生成,溶液呈红色 |
物质是氢氧化钙 |
|
| ③若有白色沉淀,溶液呈红色 |
|
(5)乙同学认为甲同学第②步验证的结论不严密,原因是 。
(6)若将一定量的Ca(OH)2溶液和100gNa2CO3溶液混合,充分反应后过滤,可得到5g白色沉淀,求该Na2CO3溶液的溶质的质量分数。
为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

4.6g常见的有机物A在空气中完全燃烧,产生二氧化碳8.8g,产生水蒸气5.4g
有机物A的名称____________________
若有机物A不完全燃烧,只产生一氧化碳和水,请问此4.6g有机物A不完全燃烧最多能产生多少克有毒气体?
BaCl2是一种重金属盐,其水溶液具有很强的毒性,若误服了BaCl2溶液,可立即服用MgSO4溶液解毒,为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
(1)P点时溶液的溶质名称是 ;
(2)反应生成沉淀的最大质量为 克;
(3)求原BaCl2溶液的溶质质量分数。

为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:
实验编号 |
第一次 |
第二次 |
第三次 |
第四次 |
加入氢氧化钠溶液质量/g |
10 |
10 |
10 |
10 |
烧杯中生成沉淀的总质量/g |
0.464 |
1.044 |
1.160 |
1.160 |
请计算:
(1)100g混合液中硫酸镁的质量。
(2)该镁矿石中镁元素的质量分数。(假设5g镁矿石中的镁元素全部转化为100g混合溶液中MgSO4中的镁元素)
(3)加入的氢氧化钠溶液的溶质质量分数。
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
烧杯中盛有锌粉和铁粉的混合物mg,向其中逐渐加入一定浓度的稀盐酸,测得剩余固体的质量与加入稀盐酸的体积的关系如图所示。下列有关结论正确的是( )
①加入V1mL稀盐酸时,剩余固体中不含锌
②加入V2mL稀盐酸时,溶液中的溶质为FeCl3和ZnCl2
③整个过程中发生反应均为置换反应
④反应中产生氢气的质量一定小于 g
g
⑤剩余固体质量m、n与稀盐酸的体积V1、V2的数量关系为 =
=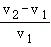

A.①②③④B.①③④C.①③⑤D.①③④⑤
钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。

提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc═CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是 。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是 (选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明 。
用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
加入CaCl2溶液的质量/g |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
反应后溶液的总质量/g |
118.0 |
136.0 |
154.0 |
M |
191.0 |
211.0 |
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
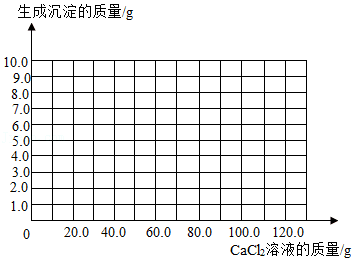
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

工业上制作电路的一种反应原理是Cu+2HCl+H2O2 CuCl2+2H2O.若反应了6.4g Cu,计算需要10%的H2O2溶液的质量。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
(3)在一烧杯中盛有Mg(OH)2和MgCl2的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).
