在天平(灵敏度极高)两边的烧杯中分别盛有100克溶质质量分数为9.8%的稀硫酸,天平平衡,再向两烧杯中分别加入相同质量的镁和铁,充分反应后,若天平平衡,则反应物中一定有剩余的物质是 ,一定没有剩余的物质是 ;若天平失去平衡,则一定没有剩余的物质是 .
如表中,有关量的变化图象与其对应叙述相符的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
以黄铁矿(主要成分为FeS 2)为原料生产硫酸的工艺流程如图所示:
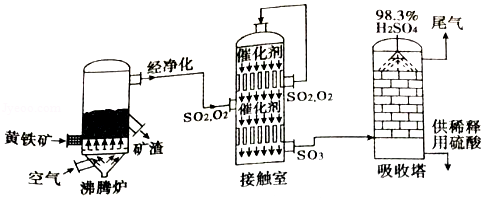
(1)沸腾炉中发生反应的化学方程式为:4FeS 2+11O 2 2X+8SO 2,其中X的化学式为 。
(2)接触室中发生反应的化学方程式为:2SO 2+O 2 2SO 3,产物SO 3中硫元素的化合价为 ;吸收塔中发生反应的化学方程式为:SO 3+H 2O═H 2SO 4,该反应的基本类型是 。若有800kg三氧化硫进入吸收塔中,且完全被吸收,则理论上制得硫酸的质量为 kg。
(3)O 2、SO 2、SO 3、H 2SO 4四种物质中属于氧化物的是 。
(4)实验室中稀释浓硫酸的操作是 。
生铁是铁的合金之一,小华为了测定某生铁样品中铁的质量分数,通过实验得到如下数据(假设生铁中的其他成分都不与稀硫酸反应):

计算:
(1)生成氢气的质量;
(2)生铁样品中铁的质量分数。
下列图象能正确表示其对应关系的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
某同学用取氯酸钾和二氧化锰的混合物20g,加热制取氧气,待完全反应并冷却后称量,得到15.2g固体物质,试计算:
(1)反应中产生氧气的质量为 ;
(2)原混合物中二氧化锰的质量.(写出计算过程)
某品牌碳酸钠试剂中含有少量氯化钠杂质,为测定试剂中碳酸钠的质量分数,取13g样品于烧杯中,加入154.4g水充分溶解,再逐滴滴入7.3%的盐酸溶液,所加盐酸溶液的质量与产生气体质量的关系如图所示.请计算:
(1)完全反应时,产生二氧化碳的质量是多少?
(2)样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)
化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取26g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为90g,反应后烧杯中物质的总质量为105g.请计算:
(1)反应生成二氧化碳的质量为 g.
(2)样品中碳酸钙的质量分数.(结果保留到0.1%)
为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气.(样品中其他成分不与稀硫酸反应,氮气不参与任何反应)

(1)实验前,先往A装置通入一会儿氮气的目的是 .
A、避免容器中的空气对实验干扰
B、检验装置的气密性
C、将反应产生的CO2气体全部赶到C装置中
(2)纯碱样品与稀硫酸充分反应后,产生的CO2气体的质量是 克.
(3)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(Na2CO3+H2SO4═Na2SO4+H2O+CO2↑)
(4)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由 .
某同学对若干块矿石样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
| 序号 |
加入稀盐酸质量(g) |
剩余固体质量(g) |
| 第1次 |
10 |
5.5 |
| 第2次 |
10 |
m |
| 第3次 |
10 |
1.2 |
| 第4次 |
10 |
1.2 |
(1)8g的石灰石样品中含有杂质 克?
(2)如表中m的数值应为 ?
(3)稀盐酸的质量分数是多少?
在化学反应2A+B2=2AB中,A 与B2反应的质量关系如图所示,现将6g A和8g B2充分反应,则生成AB的质量是
| A.9g | B.11g | C.12g | D.14g |
珍珠粉是由珍珠经加工制成的白色粉末,含有碳酸钙、蛋白质等成分,是重要的药品、化妆品原料.但市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼往往无法辨别它们.
(1)为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了如图1实验:
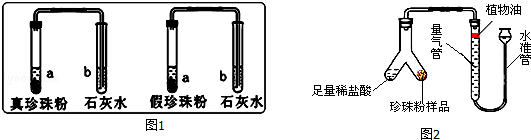
实验一:分别取真假珍珠粉适量置于两支试管中,加一定量的稀盐酸并将产生的气体通入澄清石灰水中,发现澄清石灰水均变浑浊,说明真假珍珠粉均含有 .
实验二:分别取真假珍珠粉稍许置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉未闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含 .
(2)为了比较真假珍珠粉中碳酸钙的含量,共进行了三次实验,每次各取5g真假珍珠粉,分别置于如图2实验装置中(稀盐酸足量且真假珍珠粉中只有碳酸钙与稀盐酸会反应生成气体),测定生成气体体积数据如下表:
| 样品气体体积mL次数 |
第一次 |
第二次 |
第三次 |
| 假珍珠粉 |
117.50 |
117.28 |
117.05 |
| 真珍珠粉 |
111.52 |
111.66 |
111.86 |
①量气管中水面上方加一层植物油的目的是 ,由实验数据可知:真珍珠粉中碳酸钙的含量 假珍珠粉(填“>”、“<”、“=”).
②根据三次测量结果,取平均值,算得5g真珍珠粉生成的气体质量为0.22g,求:真珍珠粉样品中CaCO3的质量分数.
在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),同学们做了如下实验:取10g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系.

(1)根据图中信息可知,与10g工业盐酸中的氯化铁反应的氢氧化钠溶液的质量为 g
(2)求该工业盐酸中氯化铁的溶质质量分数.(结果保留至 0.1%)
科学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5克 |
1.5克 |
| 第二次加入5克 |
克 |
| 第三次加入5克 |
0.5克 |
| 第四次加入5克 |
0.3克 |
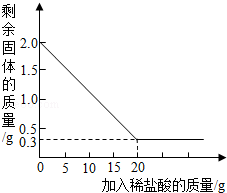
计算:
(1)分析上述图与表,第二次加入稀盐酸后,剩余固体的质量是 克;
(2)该石灰石样品中碳酸钙的质量分数;
(3)所用稀盐酸中溶质的质量分数是多少?