“宏微观相结合”、“定性研究和定量研究相结合”是研究化学反应的重要方法。以下是运用上述方法认识红磷燃烧反应的过程,请完成下列问题。
(1)写出红磷燃烧的化学方程式: ;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的 ;
(3)定量认识,从宏观角度讲, 的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧 的总个数在反应前后保持不变;
(4)现有62g红磷,要使其完全燃烧,至少需要O2多少克?(需写出计算过程)
工业炼铁。
(1)工业炼铁的主要设备是 ;
(2)工业炼铁的原料包括 (填字母):
A.焦炭 B.铁矿石 C.烧碱 D.热空气
(3)下列矿石主要成分为Fe3O4的是 (填字母):
A.赤铁矿 B.磁铁矿 C.黄铁矿
(4)写出CO与Fe2O3反应方程式: 。
铁是目前世界年产量最多的金属
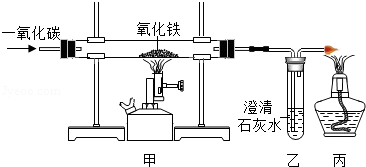
(1)如图是一氧化碳还原氧化铁实验装置图,回答下列问题:
①写出甲处玻璃管中的化学反应方程式 ;
②下列关于该实验的说法正确的是 (填字母)。
A.装置甲处玻璃管内黑色粉末变红
B.实验结束后,应先熄灭甲处的酒精喷灯
C.一氧化碳发生了还原反应
(2)每年因腐蚀而浪费掉的金属材料数量惊人,铁栅栏常采取的防锈措施是 ,除防止金属腐蚀外,保护金属资源的有效途径还有 (答一点即可)。
随着人类对能源的需求量日益增长,可燃冰的开采、氢气的开发和利用都越来越受到人们的关注。我国在可燃冰的试开采方面已取得重大突破,形成了国际领先的新型试采工艺。
(1)可燃冰主要含甲烷水合物,甲烷(CH4)完全燃烧的化学方程式为 。
(2)氢气不便于贮存,可将其转化为固态氢化物(如氢化钠等)。氢化钠(NaH)与水反应生成氢氧化钠和氢气,该反应的化学方程式为 。
制作电脑芯片的材料为高纯硅,工业上制造高纯硅的基本流程如图1所示(某些反应过程中的部分物质没有在图中标出):

(1)SiHCl3中Cl元素的化合价为﹣1价,则Si元素的化合价为 。
(2)硅原子的结构示意图如图2所示,硅原子的核电荷数为 。
(3)第①步至第④步的变化中,属于物理变化的是第 步。
(4)第④步反应,除生成纯硅以外,还有HCl生成。写出第④步反应的化学方程式 。
用化学方程式表示下列事实:
(1)纯净的氢气在空气中燃烧: 。
(2)工业上用一氧化碳和赤铁矿(主要成分是Fe 2O 3)在高温下炼铁: 。
(3)服用含氢氧化铝的药物治疗胃酸过多症: 。
(4)煅烧石灰石制取生石灰: 。
“绿水青山就是金山银山”。废旧干电池中有锌皮、铜帽(含金属Cu和Zn)、石墨、MnO2、NH4Cl等,若将生活中废旧干电池随意丢弃会造成水和土壤污染,因此将废旧干电池进行回收利用尤为重要。如图是回收废旧干电池成分的主要流程图(部分物质已略去)。

已知:2Cu+O2+2H2SO4═2CuSO4+2H2O.回答下列问题:
(1)从设备1中回收得到的非金属单质是 (填物质名称)。
(2)取少量回收得到的NH4Cl溶液于试管中,滴加硝酸酸化的硝酸银溶液,现象是 。
(3)流程中B溶液的溶质有H2SO4、 和 。
(4)写出设备Ⅲ中发生反应的化学方程式 。
如图为“胃酸完全抑制剂”的标签。
(1)“胃酸完全抑制剂”主要成分中属于碱的物质是 (写化学式)。
(2)服用“胃酸完全抑制剂”后在胃内发生反应的化学反应方程式是 。

锰及其化合物在生产中有重要作用。
(1)已知:MnSO 4+K 2MnO 4=2MnO 2↓+K 2SO 4
3MnSO 4+2KMnO 4+2H 2=5MnO 2↓+K 2SO 4+2H 2SO 4
则:①K 2MnO 4的名称是 。
上述化合物中,Mn元素化合价最高的是 。
②实验室加热高锰酸钾制取氧气后,将固体剩余物中的锰元素全部以MnO 2形式回收的方法是:将剩余物加入适量 溶液中,搅拌,充分反应后,过滤、洗涤、烘干即可。
(2)在高温下,Al与MnO 2发生置换反应可制备Mn.反应的化学方程式是 。
(3)锰锌铁氧体是一种隐形飞机表面涂料,其化学组成为 Mn xZn 1 ﹣ xFe 2O 4(铁为+3价)。
锰锌铁氧体中锰元素的化合价为 ,当锰锌铁氧体中Zn与Fe原子个数比为2:5时,它对某频段的雷达波吸收能力最强,其化学式为
实验室中现有两瓶标签被腐蚀的试剂,其中一瓶是Mg(NO3)2溶液,另一瓶是MgCl2溶液,选用AgNO3溶液作试剂,根据是否有白色沉淀产生即可将它们鉴别开来,写出反应的化学方程式 ;氢氧化钠溶液中若混有少量的氢氧化钙,只需加入适量的 (填试剂名称),然后过滤即可除去杂质。
酸雨对我们生产、生活危害较大,主要是工业生产和化石燃料燃烧产生的二氧化硫、二氧化氮排放不恰当所引起。酸雨pH 5.6(填“>”、“<”或“=”),二氧化硫与二氧化碳的某些化学性质相似,请完成化学方程式:SO2+2NaOH═ +H2O。
请回答相关问题:
(1)氧气制备是中学化学的经典实验。上世纪的教材上制取O2常使用KClO3和MnO2,下列装置中适用于该原理制取和收集O2的是 (选填编号)。实验后回收催化剂MnO2的操作是 。

(2)下表中一定呈碱性的是 ;胃酸(主要是盐酸)过多可用NaHCO3治疗,其反应化学方程式是 ;
选项 |
A |
B |
C |
体液 |
胃液 |
唾液 |
血液 |
pH |
0.9~1.5 |
6.6~7.1 |
7.35~7.45 |
为落实习近平总书记“绿水青山,就是金山银山”的理念,凉山州各级政府鼓励和支持农民变废为宝,制止焚烧秸秆,提倡利用秸秆发酵生产沼气。沼气的主要成分是甲烷,是清洁能源。
(1)甲烷完全燃烧的化学反应方程式是 ;
(2)沼气池漏气时,须排尽气体才能进入维修,且不可用明火照明。沼气还出现在煤矿的矿井、坑道,如通风不畅遇明火或铁镐撞击岩石产生火花,就会发生瓦斯爆炸。瓦斯爆炸由于发生在地下,氧气不足,生成的产物有三种,其中一种有剧毒,其化学反应方程式是 。
通常情况下,氨气(NH3)是有刺激性气味的无色气体,密度比空气小,极易溶于水,水溶液叫氨水(NH3•H2O)呈碱性,氨气与氯化氢气体相遇产生白烟,生成氯化铵。氨气在化学工业中有着广泛的用途,如制造化肥、纯碱等。根据有关信息,回答下列问题:
(1)写出氨气的物理性质(任写一点) 。
(2)“氨气与氯化氢气体相遇产生白烟”的化学方程式为 。
(3)化工厂发生大量氨气泄漏,可用洒水的方法来吸收,原因是 。
(4)某研究性学习小组用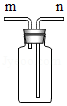 装置来收集氨气,判断氨气已收集满的方法是 。
装置来收集氨气,判断氨气已收集满的方法是 。