2017年5月,我国在南海首次试采可燃冰成功。
材料一:可燃冰的化学式为CH 4•8H 2O,相对分子质量为160,它是由甲烷气体与水高压低温条件下形成的类冰状水合物。可燃冰热值高、储藏量大。燃烧不产生污染物。
材料二:将CO 2注入海底的可燃冰储层,能将可燃冰中的CH 4"挤走",而形成二氧化碳水合物。
回答下列问题:
(1)写出甲烷(CH 4) 燃烧的化学方程式 。
(2)CH 4•8H 2O碳元素的质量分数为 。
(3)下列关于可燃冰的说法正确的是 。
A.可燃冰是一种清洁能源
B.甲烷和水形成可燃冰的过程是化学变化
C.用CO 2"挤走"可燃冰中的CH 4过程属于置换反应
神舟十一号与天宫二号的成功对接增强了国人的民族自信,推动了相关领域的研究.
(1)合金材料的研发
①合金的很多性能与组成它们的纯金属不同.图1能表示锡铅合金的是 (填序号"a""b"或"c").

②镁合金被誉为"21世纪绿色金属结构材料".Mg 17Al 12是一种特殊的镁合金,通常选择真空熔炼而非空气中熔炼的原因是 (任写一个化学方程式).该合金是一种储氢材料,完全吸氢后得到MgH 2和Al,"储氢过程"属于 (填"物理"或"化学")变化.
(2)合成材料的改良
①碱式碳酸铝镁[Mg aAl b[OH] c(CO 3) d•χH 2O]是一种新型塑料阻燃剂,其中a、b、c、d的代数关系式:2a+3b= .
②大部分塑料在自然环境中很难降解而造成"白色污染",为缓解这一环境问题可采取的措施有 (答出一点即可).
(3)CO 2的绿色利用
①目前空间站处理CO 2的一种方法是在催化剂作用下,利用H 2使CO 2转化为甲烷并得到生活用水.该反应的化学方程式为 .
②以"铁氧化物"为催化剂,利用太阳能将CO 2热解为碳和氧气,这一转化过程(如图2)中化合价升高的非金属元素是 .
2017年5月,我国首次海域可燃冰试采成功,可燃冰外观像冰,主要含有甲烷水合物(由甲烷分子和水分子组成),还含少量二氧化碳等物质。
(1)可燃冰属于 (填"纯净物"或"混合物")。
(2)化学家在较低的温度和压力下,用甲烷等为原料制成了金刚石薄膜,该变化属于 (填"物理变化"或"化学变化")。
(3)甲烷(CH 4)可用作燃料,其充分燃烧的化学方程式为 。
(4)常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体可能是 。
| A. |
H 2和CO |
B. |
H 2和C 2H 2 |
| C. |
C 2H 2和C 2H 4 |
D. |
CO和C 2H 4 |
为了比较酶与无机催化剂的催化效率,某科学兴趣小组进行了如下实验:
①取2支洁净的试管,分别编上1号和2号,向2支试管中分别加入2毫升体积分数为3%的过氧化氢溶液.
②向1号试管中滴入2滴质量分数为3.5%的FeCl 3溶液,向2号试管中滴入2滴质量分数为20%的猪肝研磨液.
③观察2支试管内产生气泡情况.
④2~3分钟后,将点燃的卫生香分别放入2支试管内液面的上方,发现2号试管的卫生棉燃烧得更旺.
查阅资料获知:每滴质量分数为3.5%的FeCl 3溶液中Fe 3+微粒数大约是每滴质量分数为20%的猪肝研磨液中过氧化氢酶微粒数的25万倍,FeCl 3溶液中起催化作用的是Fe 3+.
请回答:
(1)写出2号试管内发生反应的化学方程式: .
(2)该实验中过氧化氢分解快慢是转换为 来实现的.
(3)小明认为:上述实验中催化剂的种类和数量(微粒数)都不同,没有控制好变量,得出的结论不令人信服.小芳认为:过氧化氢酶的微粒数比Fe 3+的微粒数少得多,再根据观察到的实验现象,更能说明酶的催化效率高,你认同 (选填"小明"或"小芳")的观点.
CaCO 3在生产生活中有广泛的用途.
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为 .为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示.可知:CaO与水反应会 热量(填"放出"或"吸收");上述温度中, ℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是 .
(2)以电石渣[主要成分为Ca(OH) 2,还含有少量MgO等杂质]为原料制备高纯CaCO 3的流程如下:

①如图为NH 4Cl浓度对钙、镁浸出率的影响(浸出率=  ×100%).可知:较适宜的NH 4Cl溶液的质量分数为 ;浸取时主要反应的化学方程式为 .
×100%).可知:较适宜的NH 4Cl溶液的质量分数为 ;浸取时主要反应的化学方程式为 .
②流程中虚线内部分若改用 溶液(填化学式),可一步得到与原流程完全相同的生成物.
③流程中虚线内部若改用Na 2CO 3溶液,也能得到高纯CaCO 3,试从生物的角度分析原流程的优点:
a.NH 3可循环利用;b. .

CO 2的资源化利用日趋成为研究热点。
(1)某小组查阅资料发现:①CO 2与H 2能在催化剂表面反应生成CH 4与H 2O;②CH 4在高温下能与CuO反应。为探究上述反应,设计如下装置。

①仪器M的名称是 。装置B中反应的化学方程式为 。
②设计装置C的目的是 ,若要证明D中有CO 2生成,则需在E、F之间增加盛有 溶液的洗气瓶。
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝,该小组由此得出结论:以上实验证明CH4在高温条件下能与CuO反应。你是否同意他们的结论? (填"同意"或"不同意"),理由是 。
(2)CH 4、乙炔(C 2H 2)和丙烷(CH 3H 8)都能在空气中燃烧,但是仅C 2H 2燃烧时有浓烟。试从物质组成的角度分析其燃烧现象不同的原因是: 。CH 4燃料电池具有洁净、高效的特点,其工作时主要是将 能转化为电能。
化学用语是学习化学的重要工具.
(1)写出下列微粒的化学符号:
①镁离子 ;②二氧化氮分子 ;
③5个硅原子 ;④硝酸分子 ;
(2)用下列字母序号填空:
a.硫酸铜 b.氯化钠 c.氮气 d.石墨
① 用作调味品和防腐剂;② 用作粮食保护气;
③ 用于配制波尔多液;④ 用于生产铅笔芯;
(3)写出下列反应的化学方程式:
①盐酸与氢氧化钠溶液反应 ;②铝与氧气反应 ;
③一氧化碳与氧化铁反应 ;④用高锰酸钾制取氧气 .
在催化剂的作用下,用O 2将HCl转化为Cl 2,可提高效益,减少污染.
(1)写出反应Ⅰ的化学方程式 ;
(2)反应Ⅱ所属基本反应类型为 ;
(3)钠在氯气中燃烧生成氯化钠,若4.6g钠完全转化为氯化钠,至少需要氯气的质量是多少?

天然水净化为自来水的主要流程如下:
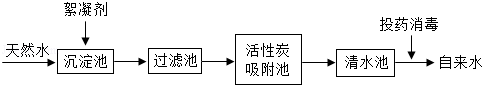
(1)下列说法不正确的是(填字母) .
A.过滤池可以除去难溶性杂质
B.活性炭吸附池可以除去水中的色素和臭味
C.清水池中一定是软水
(2)明矾[KAl(SO 4) m•12H 2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝.m= ,氢氧化铝的化学式为 .
(3)目前不少自来水用液氯(Cl 2)作为消毒剂,液氯注入水后发生反应的示意图:

其中"  "、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
"、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
①C物质的水溶液能使紫色的石蕊溶液变成 色,取C物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是 ,利用此法可检验自来水中是否含有Cl ﹣.
②液氯与水反应的化学方程式是 .
(4)天然水中微生物使有机物(以C 6H 10O 5表示)转化为CO 2和H 2O的过程中所需O 2的量叫做生化需氧量(BOD,单位为mg•L ﹣ 1),反应的化学方程式为:C 6H 10O 5+6O 2  6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
在汽油中加入适量的乙醇(C2H5OH)作为汽车燃料(车用乙醇汽油),可适当节省石油资源,并在一定程度上减少汽车尾气的污染。请回答下列问题:
(1)乙醇完全燃烧的化学方程式为 。
(2)二氧化碳和水在一定条件下可发生反应,若反应属于化合反应,则在反应后的溶液中滴加紫色石蕊溶液,溶液呈 色:若反应生成了葡萄糖,则反应条件为 。
(3)C2H5OH在物质的分类上属于 。
A.化合物 B.氧化物 C.碱 D.有机物
(4)甲醇(CH3OH)与乙醇 (填“属于”或“不属于”)同一种物质。
氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:
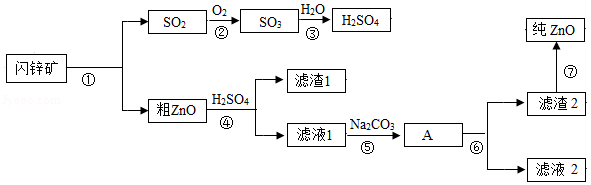
(1)已知A为碳酸锌和硫酸钠的混合物,则滤渣2的化学式为 。
(2)上述步骤中,步骤⑥的操作是 (填操作名称)。
(3)在上述步骤中,步骤 发生的反应属于分解反应。
(4)步骤④中发生的反应化学方程式为 (提示:ZnO与酸反应和Fe2O3与酸反应类似)。
纯净的二氧化硅是现代光学及光纤制品的基本原料。请回答下列问题:
(1)二氧化硅的化学性质很不活泼,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为水和四氟化硅气体),该反应的化学方程式为 。
(2)二氧化硅与碳酸钙在高温下反应生成硅酸钙( CaSiO3)和二氧化碳:在物质的分类①单质②化合物③氧化物④酸⑤碱⑥盐中,硅酸钙属于 (填序号)。
NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如图所示。
(1)还原时还原尾气可以是CO、H2等,存在如下反应:5CO+Ba(NO3)2═N2+X+5CO2
①反应中,碳元素的化合价 (填“升高”或“降低”)。
②X的化学式是 。
(2)储存时,部分NO发生反应的化学方程式为 ;吸收NOx(如NO、NO2)的物质是 。
(3)NO气体通过NSR技术转化为N2的总反应方程式是 。

高纯氧化铁[Fe 2O 3]又称"引火铁",可作催化剂,在现代工业上有广泛应用前景。以下是用赤铁矿(含少量不溶于水的SiO 2等)为原料,制备高纯氧化铁的生产流程示意图。

已知:氨水呈碱性(主要成分NH 3•H 2O是一种碱);(NH 4) 2CO 3溶液呈碱性,40℃以上易分解。
(1)写出高温时赤铁矿中的Fe 2O 3与CO发生反应的化学方程式 。
(2)①处发生反应的化学方程式为 。
(3)加入(NH 4) 2CO 3后,该反应必须控制的条件是 。
(4)加适量氨水的目的是 ,使加入的(NH 4) 2CO 3能顺利发生复分解反应而生成FeCO 3,则②处反应的化学方程式为 。
(5)用蒸馏水洗涤FeCO 3的目的是除去表面附着的杂质,洗涤干净的标志是:取最后一次洗涤液,向其中加入适量的BaCl 2溶液,无 产生(填现象),即为洗涤干净。